Solfuro di molibdeno
Il solfuro di molibdeno (o molibdenite, bisolfuro di molibdeno, disolfuro di molibdeno) è un composto chimico di formula MoS2. È un minerale di forma esagonale, colore grigio e lucentezza metallica, al tatto tanto morbido e oleoso da essere utilizzato anche come lubrificante solido.[1] È il principale minerale usato per l'estrazione del molibdeno.
| Solfuro di molibdeno | |
|---|---|
 | |
| Nome IUPAC | |
| Disolfuro di molibdeno | |
| Nomi alternativi | |
| molibdenite, bisolfuro di molibdeno | |
| Caratteristiche generali | |
| Formula bruta o molecolare | MoS2 |
| Massa molecolare (u) | 72,143 |
| Aspetto | nero, solido |
| Numero CAS | |
| Numero EINECS | 215-263-9 |
| PubChem | 14823 |
| SMILES | S=[Mo]=S |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 5.060 (solido) |
| Temperatura di fusione | 1185 °C (1458 K) (decomposizione) |
| Indicazioni di sicurezza | |
Produzione
La molibdenite viene sottoposta a flottazione con schiuma per ottenere MoS2relativamente pura, ma che tuttavia contiene ancora impurezze, principalmente costituite da carbonio. Il composto può anche essere ottenuto facendo reagire acido solfidrico con pressoché tutti i composti del molibdeno. La forma amorfa del minerale può essere rinvenuta in natura con la più rara jordisite.
La molibdenite è comunque il minerale più usato per l'estrazione del molibdeno metallico.[2]
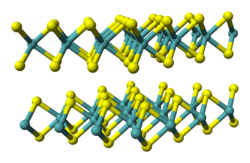
Struttura e proprietà fisiche
All'interno dei cristalli di questo composto, formata da prismi trigonali, ogni atomo di molibdeno ne coordina sei di zolfo, secondo una struttura a prisma equilatero. Ogni atomo di zolfo è dunque legato a tre atomi di molibdeno. In questo modo, i prismi triangolari sono interconnessi tra loro a formare una struttura a strati, in cui ogni strato di molibdeno ha sopra e sotto di sé uno strato di atomi di zolfo. [3] A causa delle deboli interazioni di Van der Walls, il composto ha un basso coefficiente di attrito. Vi sono anche altre sostanze ad avere proprietà lubrificanti per via della loro struttura a strati, tra cui la grafite e il nitruro di boro, a struttura esagonale.[4]
Reazioni chimiche
Il disolfuro di molibdeno è stabile all'aria(esiste infatti sotto forma di minerale ed è piuttosto comune) e non reagisce con l'ossigeno, se non dopo essere stato riscaldato. La reazione forma triossido di molibdeno:
Anche il cloro intacca il disolfuro di molibdeno a temperature elevate. Si forma pentacloruro di molibdeno:
Può inoltre reagire in condizioni controllate con il litio, con il quale forma i composti di intercalazione LixMoS2.[5] Nella reazione con n-butillitio,il prodotto è invece LiMoS2.[2]
Applicazioni
Lubricante
Il composto, dopo essere stato finemente suddiviso in particelle di dimensioni comprese tra 1 µm e 100 µm, viene usato comunemente come lubrificante solido. Esistono poche alternative che possano garantire una buona stabilità e una frizione bassa fino a 350 °C in ambienti ossidanti. Il valore del coefficiente di attrito radente del composto, misurato con un tribometro pin-on-disc con bassi carichi(0,1–2 N), è inferiore a 0,1.[6][7]
In virtù di ciò, il disolfuro di molibdeno è spesso usato come componente di miscele e materiali compositidove sia richiesta una bassa frizione. Il fatto di essere un lubrificante solido consente il suo utilizzo anche laddove lubrificanti a base di olio o grasso sarebbero inadatti. Ciò consente il suo utilizzo in applicazioni critiche, come nei motori dei velivoli. Aggiunto alle plastiche, MoS2 forma un composito con bassa frizione e più resistenza. È stato unito a diversipolimeri, tra cui il nylon(con il nome commerciale di Nylatron), il Teflon, e il Vespel. Sono stati inoltre sviluppati dei rivestimenti auto-lubrificanti per le alte temperature, formati da disolfuro di molibdeno e nitruro di titanio, realizzati con l'utilizzo della deposizione chimica da vapore.
Tra le applicazioni dei lubrificanti basati su MoS2 si annoverano la lubrificazione nei motori a due tempi, nei giunti omocinetici e nei giunti di Cardano, oltre che nella sciolina[8] e in alcuni proiettili.[9]
Petrolchimica
Il disolfuro di molibdeno viene impiegato come catalizzatore per la desolforazione nelle raffinerie di petrolio.[10] La sua efficacia viene aumentata tramite ildrogaggio con piccole quantità di cobalto o nickel.
Elettronica
È possibile produrre dei fogli di MoS2 tramite la deposizione chimica da vapore. A differenza del grafene, il disolfuro di molibdeno ha una banda proibita, essenziale per la produzione dei transistor. È stato descritto un transistor commutabile basato su un singolo strato di MoS2.[11]
Note
- ^ Molibdenite, in Treccani.it – Vocabolario Treccani on line, Roma, Istituto dell'Enciclopedia Italiana.
- ^ a b Roger F. Sebenik et al. "Molybdenum and Molybdenum Compounds" in Ullmann's Encyclopedia of Chemical Technology 2005; Wiley-VCH, Weinheim.DOI: 10.1002/14356007.a16_655
- ^ Wells, A.F., Structural Inorganic Chemistry, Oxford, Clarendon Press, 1984, ISBN 0-19-855370-6.
- ^ Thorsten Bartels et al., Lubricants and Lubrication, in Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley VCH, 2002, DOI:10.1002/14356007.a15_423.
- ^ W. Müller-Warmuth, R. Schöllhorn, Progress in intercalation research, Springer, 1994, p. 50, ISBN 0-7923-2357-2.
- ^ G. L. Miessler and D. A. Tarr, Inorganic Chemistry, 3rd Ed, Pearson/Prentice Hall publisher, 2004, ISBN 0-13-035471-6.
- ^ Shriver, D. F.; Atkins, P. W.; Overton, T. L.; Rourke, J. P.; Weller, M. T.; Armstrong, F. A., Inorganic Chemistry, New York, W. H. Freeman, 2006, ISBN 0-7167-4878-9.
- ^ On dry lubricants in ski waxes (PDF), su swixsport.com, Swix Sport AX. URL consultato il 6 gennaio 2011.
- ^ Barrels retain accuracy longer with Diamond Line, su norma.cc, Norma. URL consultato il 6 giugno 2009.
- ^ Topsøe, H.; Clausen, B. S.; Massoth, F. E., Hydrotreating Catalysis, Science and Technology, Berlin, Springer-Verlag, 1996.
- ^ Single-layer MoS2 transistors, in Nature Nanotechnology, vol. 6, n. 3, 2011, pp. 147-150, DOI:10.1038/nnano.2010.279.