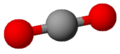
Anidride carbonica
Il biossido di carbonio (noto anche come diossido di carbonio o anidride carbonica) è un ossido acido formato da un atomo di carbonio legato a due atomi di ossigeno. È una sostanza fondamentale nei processi vitali delle piante e degli animali. È ritenuta uno dei principali gas serra presenti nell'atmosfera terrestre.
| Anidride carbonica | |
|---|---|
| Nome IUPAC | |
| diossido di carbonio | |
| Nomi alternativi | |
| biossido di carbonio
| |
| Caratteristiche generali | |
| Formula bruta o molecolare | CO2 |
| Massa molecolare (u) | 44,01 |
| Aspetto | gas incolore |
| Numero CAS | |
| Numero EINECS | 204-696-9 |
| PubChem | 280 |
| DrugBank | DBDB09157 |
| SMILES | C(=O)=O |
| Proprietà chimico-fisiche | |
| Densità (kg·m−3, in c.s.) | 1,98 |
| Solubilità in acqua | 1,45 g/l a 293 K |
| Punto triplo | 216,5 K (-56,6 °C) 5,18 × 105 Pa |
| Punto critico | 304 K (31 °C) 7,38 × 106 Pa |
| Tensione di vapore (Pa) a 293 K | 5,73 × 106 |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | -393,5 |
| ΔfG0 (kJ·mol−1) | -394,4 |
| S0m(J·K−1mol−1) | 213,8 |
| C0p,m(J·K−1mol−1) | 37,1 |
| Indicazioni di sicurezza | |
| Frasi R | -- |
| Frasi S | -- |
Si noti che il termine anidride carbonica è obsoleto nella nomenclatura IUPAC, che riserva il termine anidride a una specifica classe di composti organici.
Caratteristiche principali
A temperatura e pressione ambiente è un gas incolore e inodore. La sua formula chimica è CO2. Allo stato solido è comunemente chiamato "ghiaccio secco", ed ha numerose applicazioni in questa forma. Sublima ad una temperatura di -78 °C.
La molecola
La molecola del biossido di carbonio è lineare; ognuno dei due atomi di ossigeno è legato tramite un legame covalente doppio all'atomo di carbonio (<O=C=O>, dove con < e > si indicano 4 doppietti elettronici di non legame). L'angolo di legame neutralizza i due momenti dipolari opposti di ciascun doppio legame C=O, quindi la molecola risulta essere globalmente apolare.
Il carbonio ha numero di ossidazione 4+, si trova quindi al suo massimo stato di ossidazione possibile. Di conseguenza, il biossido di carbonio non è infiammabile e dal punto di vista chimico è relativamente inerte.
Produzione del biossido di carbonio
Il biossido di carbonio è il risultato della combustione di un composto organico in presenza di una quantità di ossigeno sufficiente a completarne l'ossidazione. In natura, viene anche prodotta da batteri aerobici durante il processo della fermentazione alcolica ed è il sottoprodotto della respirazione.
Le piante lo utilizzano per la fotosintesi che, combinandolo con l'acqua e per azione della luce solare e della clorofilla, lo trasforma in glucosio liberando ossigeno come sottoprodotto.
Il biossido di carbonio viene prodotto principalmente a partire dai seguenti processi: [1]
- come prodotto secondario da impianti di produzione di ammoniaca e idrogeno, in cui il metano è convertito in biossido di carbonio;
- da combustione di petrolio e carbonfossile; e soprattutto da centrali termoelettriche e da autoveicoli;
- come sottoprodotto della fermentazione;
- da decomposizione termica di CaCO3;
- come sottoprodotto della produzione di fosfato di sodio;
- direttamente dai pozzi naturali di biossido di carbonio.
Proprietà
Il biossido di carbonio è un gas incolore e inodore; non è tossico in sé, ma non è respirabile e quindi può provocare la morte per asfissia.
Respirare un'atmosfera particolarmente ricca di CO2 produce un sapore acidulo in bocca ed un senso di irritazione nel naso e nella gola; ciò è dovuto al suo reagire con l'acqua per formare acido carbonico.
La densità del biossido di carbonio a temperatura e pressione ambiente è circa una volta e mezzo quella dell'aria; tende quindi a stratificare sul fondo degli ambienti chiusi e non ventilati. In fase solida, a temperature superiori a -78 °C e a pressione ambiente, non liquefa, ma sublima. Il biossido di carbonio solido è noto anche come ghiaccio secco. Il biossido di carbonio può essere però liquefatto sottoponendolo ad alte pressioni a temperatura inferiore ai 31 °C.
A pressione ambiente, l'acqua è in grado di assorbire un volume circa uguale di biossido di carbonio ed ancora di più sotto pressione. Circa l'1% del biossido di carbonio assorbito si converte in acido carbonico, un acido debole, il quale a sua volta si dissocia in ioni idrossonio, ioni idrogenocarbonato e ioni carbonato.
- CO2 + H2O → H2CO3
Chimicamente, è un reagente elettrofilo. Reagisce con i reattivi di Grignard e con altri composti organometallici a dare i corrispondenti acidi carbossilici
- R-Mg-X + CO2 → R-COO-MgX → R-COOH
Reagisce inoltre con il fenolo nella reazione di Kolbe a dare l'acido 2-idrossibenzoico, ossia l'acido salicilico, il precursore dell'aspirina.
Utilizzi
Il biossido di carbonio solido, ossia il ghiaccio secco, viene usato per raffreddare e negli effetti speciali per creare la nebbia. Viene prodotto comprimendo il biossido di carbonio fino a farlo liquefare, quindi raffreddandolo e lasciandolo espandere velocemente. L'espansione causa una rapida caduta della temperatura che lo fa ghiacciare in cristalli simili a neve, che vengono quindi compressi.
Il Biossido di carbonio allo stato solido viene utilizzato nella pulitura delle superfici con il metodo della sabbiatura criogenica. Cristalli di anidride carbonica vengono lanciati contro la superficie da pulire da incrostazioni biologiche, patine minerali o altri depositi eliminandoli per il doppio effetto dell'abrasione e del forte raffreddamento localizzato che porta ad una contrazione e un irrigidimento delle parti colpite. Uno dei grandi vantaggi di questo sistema rispetto alle sabbiature tradizionali è legato al fatto che il ghiaccio secco utilizzato come sabbia sublima immediatamente riducendo fortemente la quantità di residuo da smaltire dopo l'intervento.
In un'atmosfera di biossido di carbonio il fuoco si spegne, per questo alcuni tipi di estintore contengono biossido di carbonio liquido sotto pressione a 250 atmosfere. Anche i giubbotti salvagente spesso contengono capsule di biossido di carbonio liquido, usate per ottenere un rapido gonfiaggio in caso di emergenza.
Le acque minerali frizzanti e le bibite gassate devono la loro effervescenza all'aggiunta di biossido di carbonio. Alcune bibite, tra cui la birra ed i vini frizzanti contengono biossido di carbonio come conseguenza della fermentazione che hanno subito.
Ancora, è il biossido di carbonio che fa lievitare gli impasti; molti lieviti, naturali o chimici, sviluppano biossido di carbonio per fermentazione o per reazione chimica.
Biossido di carbonio ed acqua sono le materie prime della fotosintesi; spesso l'aria all'interno delle serre è arricchita di biossido di carbonio per stimolare la crescita delle piante; inoltre un'atmosfera contenente circa l'1% di biossido di carbonio risulta letale per molti parassiti.
Il biossido di carbonio è utilizzato come fluido refrigerante in impianti di refrigerazione e di condizionamento a basso impatto ambientale. L'utilizzo della CO2 come fluido refrigerante è soggetto a condizioni particolari poiché si realizza un ciclo transcritico.
Infine, il biossido di carbonio è impiegato in alcuni tipi di laser industriali.
Tra gli additivi alimentari è identificato dalla sigla E 290.
Aspetto biologico
Il biossido di carbonio è un prodotto di rifiuto degli organismi che ottengono l'energia dall'ossidazione degli zuccheri o dei grassi, sistema di reazioni che fa parte del loro metabolismo, in un processo chiamato respirazione cellulare. Quest'ultimo è proprio di piante, animali, molti funghi e alcuni batteri. Negli animali superiori, il biossido di carbonio si muove nel sangue (in soluzione) andando dai tessuti del corpo ai polmoni, dove viene espirato.
Il biossido di carbonio nell'aria è presente in quantità dello 0,04% circa, mentre nell'aria esalata dopo un respiro è circa il 4,5%. Un'atmosfera che contiene oltre il 5% di biossido di carbonio è tossica per gli esseri umani e per gli animali, dato che va a saturare l'emoglobina del sangue impedendole di legarsi all'ossigeno e bloccando quindi l'ossigenazione dei tessuti. Sia quando viene usato in forma gassosa, sia quando viene usato come ghiaccio secco, il biossido di carbonio va maneggiato in spazi ben areati.
I limiti fissati dall'OSHA (l'agenzia statunitense per la sicurezza sui luoghi di lavoro) per la concentrazione di biossido di carbonio sul posto di lavoro sono lo 0,5% (5000 ppm) per un'esposizione continua e il 3% per un'esposizione breve (15 minuti).
Il biossido di carbonio è comunque molto meno tossico dell'ossido di carbonio, CO, che produce incoscienza nel giro di pochi minuti e la possibilità di danni irreversibili e morte in breve tempo.
La maggior parte del biossido di carbonio presente nel sangue (il 72%) è presente in forma di ione idrogenocarbonato, HCO3-, dove funge da tampone per la regolazione del pH sanguigno. Il livello ottimale dello ione idrogenocarbonato è mantenuto attraverso la frequenza del respiro e la contrazione o la dilatazione dei vasi sanguigni e delle vie polmonari.
Esposte alla luce, le piante assorbono biossido di carbonio dall'atmosfera attraverso la fotosintesi, tramite il quale biossido di carbonio ed acqua vengono convertiti in glucosio e ossigeno. In assenza di luce, anche le piante emettono biossido di carbonio in conseguenza della respirazione cellulare.
Presenza in natura
Atmosfera
Nel 2007 è stato misurato un contenuto di biossido di carbonio nell'atmosfera terrestre di circa dello 0,038% (≈ 381 ppm) in volume.[2] Per via della maggiore estensione delle terre emerse e quindi della maggiore superficie occupata da vegetazione, nell'emisfero nord della Terra si osserva una fluttuazione della concentrazione di biossido di carbonio di circa 5 ppm nell'arco dell'anno, che raggiunge il suo massimo a maggio ed il suo minimo ad ottobre, al termine della stagione vegetativa dell'emisfero nord, quando la biomassa vegetale del pianeta è al suo valore massimo.
Nonostante la sua piccola concentrazione, la CO2 è un componente fondamentale dell'atmosfera terrestre perché - insieme al vapore acqueo ed al metano - intrappola la radiazione infrarossa della luce solare riflettendola nuovamente verso la superficie terrestre (il cosiddetto effetto serra) impedendo alla Terra di raffreddarsi. Sono stati i vulcani le prime fonti di biossido di carbonio atmosferico della Terra neonata, grazie ad essa si è potuto instaurare un clima favorevole allo sviluppo della vita. Oggi i vulcani rilasciano in atmosfera circa 130 - 230 milioni di tonnellate di biossido di carbonio ogni anno, ma questa quantità rappresenta meno dell'1% della quantità di biossido di carbonio totale liberata in atmosfera dalle attività umane, che è pari a 27 miliardi di tonnellate all'anno: 50.000 tonnellate al minuto.
Si stima che la concentrazione atmosferica di biossido di carbonio prima della rivoluzione industriale fosse 280 ppm, e che quindi sia aumentata del 35% dai tempi della rivoluzione industriale e del 20% dal 1958. La combustione dei combustibili fossili (carbone, petrolio) è la causa di questo aumento per il 64%, mentre la deforestazione è la seconda con il 34%[3].
La teoria del riscaldamento globale compare nella letteratura scientifica per la prima volta alla fine del XIX secolo. L'aumento della quantità di anidride carbonica nell'atmosfera va ad incrementare l'effetto serra e contribuisce quindi ad un aumento della temperatura media del pianeta, al quale gli ecosistemi non hanno il tempo necessario per adattarsi. L'entità di questo effetto è ancora in discussione, ma la diffusa convinzione che stiamo in effetti attraversando una fase di riscaldamento generalizzato del clima terrestre ha portato molti paesi del mondo a siglare il protocollo di Kyōto, un accordo in cui le nazioni si impegnano a limitare e ridurre le emissioni di biossido di carbonio, affinché la sua concentrazione resti al di sotto di 450 ppm: nell'ultimo decennio (1999-2009) il livello di biossido di carbonio nell'aria è aumentato di 2 ppm all'anno, ed è in costante accelerazione. Se le emissioni non saranno ridotte secondo gli accordi, il livello di soglia stabilito a Kyōto verrà quindi superato nel 2030 circa. Secondo i modelli climatologici più accreditati il superamento di questa soglia porterà la temperatura media della terra ad aumentare di due gradi, e il livello dei mari ad innalzarsi di almeno un metro entro il 2040. Altri studi, ritenuti meno verosimili, prevedono fino a 6 gradi di aumento di temperatura e fino a 3 metri di innalzamento dei mari.
Oceani
Gli oceani della Terra contengono quantità enormi di biossido di carbonio sotto forma di ioni bicarbonato e carbonato, più di quanta ce ne sia nell'atmosfera. Lo ione idrogenocarbonato viene prodotto per azione del biossido di carbonio libero sulle rocce calcaree - un esempio è la reazione di dissoluzione del carbonato di calcio:
- CaCO3 + CO2 + H2O → Ca2+ + 2 HCO3-
È attraverso reazioni come questa che gli oceani vanno a tamponare le variazioni di concentrazione del biossido di carbonio nell'atmosfera; la reazione è infatti reversibile. Per centinaia di milioni di anni questo processo ha prodotto enormi quantità di rocce costituite da carbonati che sono andati a depositarsi sui fondali marini.
Con l'aumentare della concentrazione del biossido di carbonio nell'atmosfera, aumenta la quantità di ioni idrogenocarbonato presente nelle acque marine con conseguente abbassamento del pH, fenomeno noto come acidificazione degli oceani. Si ritiene che gli aumenti di temperatura ed acidità siano all'origine della morte delle barriere coralline osservata negli ultimi anni in numerose zone tropicali del pianeta.
Storia
Il comportamento del biossido di carbonio fu descritto per la prima volta dal chimico Jean Baptiste van Helmont nel XVII secolo.
Cattura e sequestro (Carbon Capture & Sequestration - CCS)
Il principale metodo per smaltire enormi quantità di biossido di carbonio è la fotosintesi clorofilliana svolta dai vegetali: questo processo coinvolge luce, biossido di carbonio ed acqua trasformandoli in ossigeno e glucosio; consiste quindi nel piantare e/o preservare foreste. Questo è il modo più semplice economico e spontaneo, che praticamente avviene naturalmente sul nostro pianeta da quando esistono i vegetali.
Sono allo studio metodi artificiali di cattura e sequestro del carbonio col fine di catturare, trasportare e stoccare la CO2 per contrastare l'innalzamento della concentrazione di questo gas serra. In tal caso la cattura del biossido di carbonio si ha nei siti ove viene prodotta in grande quantità: fumi di combustione (es. centrali termoelettriche a carbone o a gas) o da residui di raffinazione; il "sequestro" consiste nell'iniezione nel sottosuolo ove l'anidride carbonica può rimanere segregata grazie a diversi meccanismi chimico-fisici.
Oggi esistono tre principali siti di sperimentazione di sequestro geologico, tutti legati all'industria petrolifera: Weyburn in Canada, In Salah in Algeria e Sleipner nell'offshore norvegese. La quantità di biossido di carbonio sequestrato da questi progetti è dell'ordine del milione di tonnellate all'anno, in realtà una quantità molto modesta. Sleipner è in funzione dal 1995.
Questi metodi formalmente non smaltiscono il biossido di carbonio ma prevedono il suo stoccaggio in sacche sotterranee che dovrebbero trattenere la molecola per migliaia di anni.[4]
Sono state avanzate alcune proposte d'ingegneria per la cattura di biossido di carbonio direttamente dall'atmosfera ma gli sviluppi, se pur ben promettenti, sono solo agli inizi. La GRT, Global Research Technologies, di Tucson, Arizona ha dimostrato nel 2007 che il suo pre-prototipo è in grado di ottenere i risultati prefissi[5][6]. La commercializzazione di queste attrezzature a livello mondiale avverrà entro il 2010[7].Il successo è anche Italiano in quanto un ingegnere catanese, Simone Vitale, fa parte del team d'ingegneria della GRT. Questi macchinari potrebbero essere utilizzati in larga scala per la cattura di CO2 emesso non solo da fonti industriali ma anche da automobili ed aeroplani[8].
Note
- ^ Pierantozzi, Ronald (2001). "Carbon Dioxide". Kirk-Othmer Encyclopedia of Chemical Technology. Wiley.
- ^ Monthly and annual atmospheric CO2 record from continuous measurements at Jubany Station
- ^ Frequently Asked Global Change Questions
- ^ Un serbatoio contro l'effetto serra
- ^ First Successful Demonstration of Carbon Dioxide Air Capture Technology Achieved by Columbia University Scientist and Private Company
- ^ Machine to clean up greenhouse gas is breakthrough in war on global warming, say scientists
- ^ GRT's Future Commercial Air-Capture Products Will Address CO2 Market Needs in Sectors Ranging From Agriculture to Energy
- ^ Tesi di laurea di Joshua K. Stolaroff
Voci correlate
Altri progetti
- Wikiquote contiene citazioni di o su anidride carbonica
- Wikimedia Commons contiene immagini o altri file su anidride carbonica
Collegamenti esterni
- (EN) Informazioni sul ghiaccio secco
- (EN) Bassam Z. Shakhashiri: Il composto della settimana: l'anidride carbonica
- (EN) Keeling, C.D. and T.P. Whorf: Controllo sull'anidride carbonica atmosferica dall'osservatorio di Manua Loa, 2002
- (EN) Aggiornamenti da Mauna Loa 2004
- (IT) Centro Studi Galileo - CO2 come gas refrigerante
- (EN) Catalogo delle Emissioni Naturali di CO2 in Italia - [1]