Cofattore molibdeno
Il cofattore molibdeno è un cofattore derivante dalla complessazione di uno ione molibdeno da parte della molibdopterina. È conosciuto in letteratura come Moco dall'abbreviazione inglese di molybdenum cofactor [1] [2].
| Cofattore molibdeno | |
|---|---|
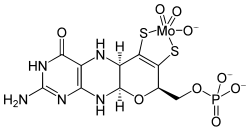 | |
| Nomi alternativi | |
| Moco | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C10H12Mo1Mo1N5O8P1S2 |
| Massa molecolare (u) | 521,27 |
| Numero CAS | |
| PubChem | 135564989 |
| DrugBank | DBDB02137 |
| SMILES | [S-]C1=C([S-])C(N2)C(OC1COP(O)(O)=O)NC3=C2C(N=C(N)N3)=O.O=[Mo+2]=O |
| Indicazioni di sicurezza | |
Il cofattore molibdeno in natura
Il Moco è contenuto nei molibdo-enzimi mononucleari[3]. Tutti gli animali, le piante terrestri, alghe, eteroconti e certi funghi posseggono i geni per la biosintesi del Moco e molibdo-enzimi. Organismi spesso associati ad altri come tutti i parassiti, i lieviti e ciliati indipendenti non li possegono, ma si pensa che possano rifornirsi di Moco dall'organismo ospite[4].
Biosintesi del cofattore molibdeno
La biosintesi del cofattore molibdeno (Moco) segue un antica e onnipresente sequenza di reazioni che portano all'attivazione biochimica del molibdeno. Difetti genetici nella via biosintetica del Moco per l'uomo causano forti anormalità neurologiche e morte nella prima infanzia. In totale più di 10 geni sono coinvolti in tale biosintesi, e le corrispondenti proteine sono state trovate altamente conservate in vari organismi.
La biosintesi, studiata principalmente in batteri, può essere divisa in 4 passaggiprincipali partendo dal GTP [5]:
- Formazione del precursore Z
- formazione della molibdopterina dal precursore Z
- insersione del molibdato per formare il Moco
- modificazioni addizionali del Moco
Enzimi facenti parte della famiglia della solfito ossidasi legano il Moco senza ulteriori modificazione, mentre solo dopo ulteriori trasformazioni il Moco può essere inserito in quelli della famiglia della DMSO reduttasi e della xantina ossidasi.
Note
- ^ James J. Truglio, Karsten Theis, Silke Leimkühler, Roberto Rappa, K. V. Rajagopalan, Caroline Kisker, Crystal Structures of the Active and Alloxanthine-Inhibited Forms of Xanthine Dehydrogenase from Rhodobacter capsulatus, in Structure, vol. 10, n. 1, 2002-01, pp. 115-125, DOI:10.1016/S0969-2126(01)00697-9, ISSN 0969-2126.
- ^ Maria João Romão, Molybdenum and tungsten enzymes: a crystallographic and mechanistic overview, in Dalton Transactions, n. 21, 2009, pp. 4053-4068.
- ^ R. Hille, 10.1021/cr950061t The Mononuclear Molybdenum Enzymes, in Chemical reviews, vol. 96, 1996, pp. 2757-2816, DOI:DOI: 10.1021/cr950061t.
- ^ Yan Zhang, Vadim N Gladyshev, Molybdoproteomes and evolution of molybdenum utilization, in Journal of Molecular Biology, vol. 379, n. 4, 13 giugno 2008, pp. 881-899, DOI:10.1016/j.jmb.2008.03.051, ISSN 1089-8638.
- ^ M. Fischer, B. Thöny, S. Leimkühler, The biosynthesis of folate and pterins and their enzymology, in Comprehensive Natural Products II: Chemistry and Biology, 2010, pp. 599-648, ISBN 978-0-08-045381-1.