Psoriasi
La psoriasi è una malattia infiammatoria cronica della pelle, non infettiva né contagiosa, solitamente di carattere cronico e recidivante. Nella sua patogenesi intervengono fattori autoimmunitari, genetici e ambientali. Se ne riconoscono più forme: psoriasi non pustolosa (la cui forma volgare riveste 80-90% delle forme di psoriasi), psoriasi pustolosa e altre forme. Circa il 30% dei soggetti affetti da psoriasi svilupperanno successivamente l'artrite psorisiaca.
| Psoriasi | |
|---|---|
 | |
| Specialità | dermatologia |
| Classificazione e risorse esterne (EN) | |
| ICD-9-CM | 696 |
| ICD-10 | L40 |
| OMIM | 177900 |
| MeSH | D011565 |
| MedlinePlus | 000434 |
| eMedicine | 1943419, 1108072, 1107850, 1107949, 1108220, 331037 e 394752 |
Cenni storici
Secondo alcuni studiosi le prime descrizioni riguardanti la psoriasi comparirebbero già nei Codici Assiro Babilonesi (2000 a.C. circa) che ci parlano di malattie cutanee squamo crostose, in alcuni papiri egiziani e in diversi libri dell'Antico Testamento.
La psoriasi farebbe parte delle malattie della pelle a cui si riferisce la Bibbia nei capitoli 13 e 14 del Levitico e che nella Bibbia ebraica sono definite Tzaraat. "Se un uomo avrà nella pelle del suo corpo una pustola o una macchia bianca …la piaga di Tzaraat ... quel tale sarà condotto dal sacerdote che esaminerà la piaga sulla pelle del corpo"
Per tali malattie della pelle vengono anche fornite alcune prescrizioni comportamentali. Una indiretta conferma potrebbe venire dal fatto che in ebraico la parola attualmente utilizzata per definire la psoriasi è sapachat ed è di origine biblica, ma di significato sconosciuto.[1]
Ippocrate nel 5° secolo a.C. fornisce una descrizione piuttosto dettagliata di alcune lesioni desquamative, verosimilmente psoriasiche e ad esse si riferisce con il nome di “psora”. Celso nel 1° secolo dopo Cristo dà una descrizione accurata della dermatosi e suggerisce di trattarla con preparati allo zolfo. Il medico greco Claudio Galeno usò il termine "psoriasi" riferendosi ad alcune lesioni cutanee squamose e pruriginose, consigliando i pazienti di avvalersi di bagni frequenti ed unguenti grassi.[2]
Per oltre mille anni la conoscenza e la terapia della dermatosi non fa progressi ed i medici consigliano i pazienti di avvalersi di bagni con acque sulfuree, di fanghi, di pomate grasse o di olii veicolanti catrami e preparati sulfurei. La malattia viene spesso alternativamente scambiata per lebbra o scabbia, il che porta frequentemente all'isolamento sociale dei pazienti.[3][4]
La malattia verso la fine del 18° secolo diviene nota come "lepra di Willan" quando i dermatologi inglesi Robert Willan (1757-1812) e Thomas Bateman la differenziano rispetto ad altre malattie della pelle e ne chiariscono le manifestazioni e complicanze.
A loro parere la lebbra si caratterizza per le lesioni di forma regolare e circolare, mentre la psoriasi è sempre di aspetto e forma irregolare. Robert Willan identificò due diverse categorie di lesioni, la psoriasi discoide che chiamò leprosa Graecorum (equivalente alla Lepra Vulgaris o Lepra willani) e la psora leprosa.[5]
I più famosi dermatologi del 19° secolo si dedicarono all'approfondimento dello studio della malattia, la quale a loro parere era sistemica (parlavano infatti di "malattia psoriasica"), ritenendola collegata ad alterazioni non meglio specificate degli organi interni e del sistema nervoso.
Solo nel 1841 ad opera del dermatologo austriaco Ferdinand von Hebra, fondatore della nuova scuola viennese di dermatologia, alla condizione venne finalmente dato il nome definitivo di psoriasi, derivato dal termine greco psora che significa appunto prurito.[6][7] La descrizione è rinvenibile nell'opera di von Hebra Atlas der Hautkrankeiten (Atlante di malattie della pelle).
Storia dei trattamenti
La storia della psoriasi è costellata di trattamenti di dubbia efficacia e di tossicità elevata. Questi trattamenti hanno goduto di breve ed ampia popolarità in particolari periodi di tempo od in determinate aree geografiche.
Gli antichi egiziani erano soliti tentare cure topiche basate su sostanze catramose ed escrementi di cani, gatti e di altri animali.
Rimedi fantasiosi basati su acque sulfuree, urina, sali marini da applicarsi localmente si associano a terapie orali che richiedono di sorseggiare brodo di vipera.
Verso la metà del 1700, specialmente nel Regno Unito, viene consigliata una cura della psoriasi con preparati a base di mercurio: la terapia comprende sia applicazioni locali che un trattamento per via generale. La tossicità del mercurio rende presto poco popolare questo tentativo terapeutico. E tuttavia il mercurio rimane utilizzato a lungo in paste ed unguenti per il trattamento di malattie della pelle e psoriasi.[8][9][10]
Da notare che anche in anni più recenti è stata tentato il trattamento di questa patologia con complessi di rame e preparazioni contenenti salicilato di rame, con scarsi risultati ed effetti tossici.[11]
Nel 18° e 19° secolo la psoriasi, tra i vari rimedi, fu curata ricorrendo alla cosiddetta soluzione di Fowler, vale a dire una soluzione contenente un 1% di arsenico di potassio. Anche in questo caso il composto si è rivelato estremamente tossico e cancerogeno.[10][12]
Ciò nonostante l'arsenico continuò ad essere ampiamente utilizzato in dermatologia, sia negli USA che in Europa, sotto forma di soluzione di Fowler e di pillole asiatiche contenenti anche oppio o pepe.[13] L'arsenico fa tutt'ora parte della medicina tradizionale cinese.[14]
Nel corso del 20° secolo i raggi Grenz (detti anche raggi Bucky) una forma di radiazioni X morbide, sono stati ampiamente utilizzati nel trattamento della psoriasi e di altri disturbi della pelle. Il preciso meccanismo di azione di questi raggi non è mai stato compreso pienamente ma il trattamento sembra avere un ottimo effetto sulla psoriasi, in particolare del cuoio capelluto.[15][16] Questa terapia in anni più recenti è stata rimpiazzata dalla terapia con raggi ultravioletti.
Epidemiologia
La psoriasi nei soggetti di razza caucasica colpisce il sesso maschile e quello femminile con uguale frequenza.
Negli orientali, ed in particolare nei giapponesi, il sesso maschile è predominante rispetto al femminile, con un rapporto di 2 a 1.[17] Può presentarsi a qualunque età, ma è più comune dai 10 ai 40 anni, ed in particolare al momento della pubertà e della menopausa. Poiché i pazienti affetti da psoriasi hanno una aspettativa di vita simile a quella di individui non malati, la prevalenza della malattia aumenta con l'età.[18][19] La psoriasi viene riscontrata nel 2-3% della popolazione generale, con una prevalenza dello 0,1% in Giappone,[20][17] dell' 1,5% nella popolazione della Gran Bretagna,[21] del 2,6% della popolazione USA e di percentuali minori nei paesi dell’Africa occidentale. In Italia stando ai dati dello studio PraKtis, uno studio condotto dal Centro Studi GISED in collaborazione con DOXA ed il Laboratorio di Epidemiologia Generale dell’Istituto di Ricerche Farmacologiche Mario Negri, la prevalenza della psoriasi raggiunge il 3,1%, dimostrando di essere una fra le malattie dermatologiche più frequenti.[22]
L'incidenza e prevalenza della psoriasi è in realtà assai poco chiara. Secondo una review del 2012 che ha preso in considerazione 53 studi effettuati in tutto il mondo la prevalenza nei bambini varia da uno 0% (a Taiwan) fino al 2.1% (proprio in Italia). Negli adulti lo stesso dato va dallo 0.91% registrato negli Stati Uniti al 8.5% del valore riscontrato in Norvegia.
Sempre negli adulti la malattia varia dal 78.9/100,000 soggetti ogni anno (Stati Uniti) fino ai 230/100,000 soggetti-anno che si registrano in Italia.
Questi dati così variegati sembrano suggerire che la malattia si differenzia non solo a seconda della fascia di età che si prende in considerazione, ma anche della regione geografica oggetto di studio, con una tendenza ad una frequenza più elevata nei paesi più distanti dall'equatore.[23]
Eziologia
L'eziologia della psoriasi è ancora sconosciuta, anche se alcuni dati a disposizione sembrano indicare una origine polifattoriale. Nella suscettibilità alla psoriasi ed alla artrite psorisiaca sono certamente implicati fattori genetici, fattori immunitari e fattori ambientali.[24]
Attualmente sono due le ipotesi principali inerenti il processo che si verifica nello sviluppo della malattia.
La prima ipotesi considera la psoriasi come un disturbo di eccessiva crescita e riproduzione delle cellule della pelle. Il problema è semplicemente visto come un disturbo dell'epidermide e dei cheratinociti.
La seconda ipotesi vede la malattia come un disordine immuno-mediato in cui l'eccessiva riproduzione delle cellule della pelle è secondario a fattori prodotti dal sistema immunitario.
I linfociti T, che giocano un ruolo centrale nella immunità cellulo-mediata, si attivano e migrano verso il derma, innescando il rilascio di citochine (in particolare il fattore di necrosi tumorale-alfa TNF-α) che a loro volta causano infiammazione e riproduzione rapida di cellule della pelle. Non è ancora chiaro quale siano i fattori che innescano l'attivazione delle cellule T.
L'ipotesi immuno-mediata è stata sostenuta dall'osservazione che i farmaci immunosoppressori possono ridurre o risolvere le placche psoriasiche. Tuttavia, il ruolo del sistema immunitario non è pienamente compreso. Infatti è stato recentemente riportato che in topi privi di linfociti T è possibile scatenare lesioni di tipo psoriasico. I modelli animali, tuttavia, solo per alcuni aspetti possono essere sovrapponibili alla psoriasi umana.[25]
Una compromissione della funzione di barriera della pelle sembra avere un ruolo nella suscettibilità allo sviluppo della psoriasi.[26]
La psoriasi per certi aspetti sembra essere una malattia di tipo idiosincrasico. La maggior parte dei soggetti affetti da psoriasi sperimentano che la malattia può peggiorare o migliorare senza un motivo apparente.
Gli studi sui fattori associati alla psoriasi sono tendenzialmente limitati dal fatto che si basano su campioni di piccole dimensioni, ed in genere individui ospedalizzati. Questi studi quindi non sempre possono essere definiti rappresentativi della popolazione sofferente di psoriasi, ed infatti spesso in letteratura medica sono riportati risultati contrastanti.
L'evento scatenante il primo focolaio di psoriasi è talvolta uno stress, fisico o mentale, un trauma o lesioni della cute, oppure una infezione, spesso da streptococco.
Altre condizioni che sono stati segnalate come associate ad un peggioramento della malattia comprendono gli stress di varia natura, fattori psicosomatici,[27] i cambiamenti di stagione e del clima, gli stessi processi infettivi.
Anche alcuni medicinali, tra cui i sali di litio, i beta-bloccanti e la clorochina (un farmaco antimalarico) possono innescare od aggravare la malattia.
Il consumo eccessivo di alcol, il fumo di sigaretta e l'obesità possono esacerbare la psoriasi o renderne complicato il trattamento.[28][29]
Secondo alcuni autori queste comorbidità sono gli effetti piuttosto che le cause della malattia.
Patogenesi
Esiste una forte evidenza che la psoriasi sia una malattia polifattoriale, caratterizzata da una notevole eterogenicità genetica, clinica ed istologica, anche a livello delle stesse lesioni.
Sembra assodato che la disregolazione del comparto dell'immunità cellulo-mediata (linfociti T) e della risposta epidermica a certi stimoli giochi un ruolo fondamentale nella genesi e nel mantenimento di questo disturbo. In particolare sembra che vi siano vari fattori scatenanti la disregolazione dei linfociti T.
Fattori genetici
È noto che l'incidenza della psoriasi è aumentata in individui con HLA-B13, HLA-B17, HLA-DR7, HLA-Bw57 anche se la penetranza dei geni sembra essere piuttosto bassa e la loro espressione irregolare. L'associazione più forte con gli antigeni di istocompatibilità di classe I è comunque con HLA-Cw06.[24]
Nei primi studi sull'ereditarietà della psoriasi si ipotizzò che la malattia fosse trasmissibile come carattere autosomico dominante con una penetranza del 60%.[30]
Tale ipotesi era errata e nel 1972 Watson propose un modello di ereditarietà multifattoriale.
Secondo questo modello per il verificarsi dell'insorgenza della psoriasi era necessaria l'integrazione sia di più fattori genici sia di eventi scatenanti. Questi ultimi sono in genere di tipo antigenico e/o ambientale.
Nello studio di Watson si evidenziava come l'incidenza della psoriasi in figli di genitori sani, cioè privi di alterazioni psorisiache, fosse del 7,8%. Tale percentuale aumentava al 16,4% quando un solo genitore era affetto da psoriasi per raggiungere una percentuale del 50% se entrambi i genitori erano affetti.[31]
I pazienti con familiarità tendenzialmente presentano le lesioni a un'età minore, statisticamente significativa, rispetto a quelli di pazienti senza familiarità.
In uno studio del 2009 con l'obiettivo di determinare il rischio di ricorrenza di artrite psoriasica e di psoriasi non complicata in parenti di primo grado di pazienti affetti da artrite psoriasica ha dimostrato che tale rischio, una buona stima della ereditabilità della malattia, è di 30-55% nei parenti di primo grado di soggetti affetti da artrite psorisiaca, mentre scende a 8-10% nei parenti di primo grado di soggetti affetti da psoriasi.[32]
Il valore principale degli studi genetici sulla psoriasi sta certamente nel tentativo di scoprire i meccanismi molecolari in gioco e le vie enzimatiche al fine di identificare potenziali bersagli di nuovi farmaci.[33][34]
L'analisi di linkage (concatenazione) dell'intero genoma ha identificato nove loci (posizioni), su cromosomi diversi, associati alla psoriasi.
Tali loci sono definiti loci di suscettibilità della psoriasi (PSORS) e sono stati numerati da 1 a 9.[35][36] Il primo di questi locus (PSORS1) si trova all'interno della regione HLA (6p21.3). Una forte associazione dell'allele HLA-Cw6 con questo locus fu riportata per la prima volta in letteratura medica in uno studio sulla popolazione finlandese.
All'interno dei loci già citati troviamo una serie di geni. Molti di questi geni sono su vie metaboliche coinvolte nel processo infiammatorio. Alcune mutazioni di questi geni sono estremamente comuni nella psoriasi.
Il fattore chiave è verosimilmente PSORS1, che dà conto del 35-50% della ereditarietà della psoriasi. PSORS1 controlla geni che codificano per proteine che influenzano il sistema immunitario o che si trovano nella pelle in quantità maggiore nei soggetti con psoriasi. PSORS1 si trova sul cromosoma 6 nel complesso maggiore di istocompatibilità (MHC).[37]
Tre geni del locus PSORS1 hanno una forte associazione con la psoriasi volgare:
HLA-C variante HLA-Cw6, che codifica per una proteina MHC di classe I; CCHCR1 variante WWC, che codifica per una proteina a spirale la quale risulta iperespressa nella epidermide dei soggetti affetti da psoriasi; CDSM, variante allele 5, che codifica la corneodesmosina, una proteina cutanea di adesione, molto importante nella fase terminale di differenziazione dell'epidermide, iperespressa nella psoriasi.
Gli studi di tipo genomico hanno evidenziato che, oltre a quelli già citati, anche altri geni sono coinvolti in alcune caratteristiche varianti della psoriasi. Alcuni di questi geni codificano per proteine che fungono da mediatori dell'infiammazione e che hannno come bersaglio alcune cellule del sistema immunitario. Alcuni di questi geni sono coinvolti anche in altre malattie autoimmuni.
Fra questi geni una menzione particolare meritano: IL12B, posto sul cromosoma 5q, che esprime l'interleuchina-12B; IL23R, posto sul cromosoma 1p, che esprime il recettore dell'interleuchina-23, ed è coinvolto nel processo di differenziazione delle cellule T.[38][39][40]
Questi geni sono sulla via metabolica che termina la upregulation (sovraregolazione) del fattore di necrosi tumorale-α e del fattore nucleare kB, coinvolti nel processo infiammatorio.
Nel 2012 è stato identificato il primo gene direttamente collegato alla psoriasi. Alcuni studi scientifici hanno suggerito che una rara mutazione nel gene codificante per la proteina CARD14 più un innesco ambientale sia sufficiente a causare la psoriasi a placche, cioè la forma più comune di psoriasi.[41][42]
Fattori post-infettivi
È risaputo che la psoriasi (forma guttata) è spesso preceduta da infezioni di streptococco α-emolitico, e in alcuni casi da infezioni da virus di varicella-zoster. Un altro fattore verosimilmente implicato sono i cosiddetti superantigeni, tossine batteriche che by-passano il normale controllo e attivano in maniera esagerata i linfociti T. Tuttavia ad oggi non è stato mai identificato un autoantigene responsabile della malattia. Ne cloni linfocitari proliferativi per qualche antigene esogeno.
Fattori autoimmuni
Ancora un altro fattore possibile sono i fattori autoimmuni: una buona percentuale di pazienti psoriasici produce anticorpi (IgA e IgG) per la gliadina, con conseguente attivazione della risposta linfocitaria. I pazienti mostrano una riduzione dei sintomi con diete senza glutine.
Fattori immunologici
Qualunque sia il fattore scatenante, il pool di linfociti T attivati causa il rilascio di varie sostanze attive (γ-interferone, linfochine). Queste agiscono a vari livelli sull’epidermide, ma non possono essere le uniche responsabili della reazione. L’epidermide psoriasica è infatti già predisposta a una risposta abnorme: i livelli di varie sostanze e la reattività dei tessuti a sostanze normalmente presenti sono infatti anormali. La pelle psoriasica presenta alti livelli di Nerve growth factor (NGF), che stimolano la proliferazione dei cheratinociti e media la flogosi, di β-endorfina e di fattori angiogenici, e presenta una risposta aberrante al γ-interferone, con riduzione piuttosto che aumento, dell'apoptosi cellulare. Il risultato finale dell’interazione tra sostanze attive e substrato attivato è la proliferazione dei cheratinociti, la loro incompleta maturazione, la neovascolarizzazione e la flogosi. A loro volta i cheratinociti rilasciano delle chemochine che stimolano ulteriormente i linfociti T, creando così un circolo vizioso di flogosi autoindotta.
È stato recentemente proposto che a questo meccanismo, che spiega la flogosi cronica e diffusa, ne debba essere aggiunto un altro, legato a esso ma peculiare delle lesioni acute infiltrate. Questo meccanismo implica un ruolo attivo delle infiltrazioni di neutrofili, riscontrabili appunto a livello delle lesioni più acute e attive. Esse vengono stimolate dalle chemochine e dalle linfochine rilasciate rispettivamente da cheratinociti e linfociti T, e a loro volta stimolano l’attività di linfociti e cheratinociti. Si verrebbe quindi a creare un secondo circolo vizioso limitato alle lesioni acute ma legato comunque alla flogosi di sottofondo.
Anatomia patologica
Le lesioni psoriasiche si presentano a livello istologico come zone di iperproliferazione, con un turnover epidermico accelerato di circa 10 volte rispetto alla pelle normale, con una incompleta maturazione dei cheratociti e mantenimento dei nuclei nello strato corneo (paracheratosi), con neovascolarizzazione tortuosa, aumento del flusso ematico, essudato proteico e vasi linfatici immaturi; da notare l'infiltrazione di neutrofili polimorfi nell’epidermide. Anche la pelle non lesionata dei pazienti psoriasici presenta delle anormalità: la psoriasi viene indotta più facilmente, in particolare dopo un trauma (Fenomeno di Koebner), e vari medicinali possono causare delle acutizzazioni. Vi sono più cellule disponibili per sintesi del DNA e i livelli di glicogeno (più elevati nelle lesioni) sono ridotti rispetto alla pelle di individui non psoriasici.
Fattori scatenanti e/o esacerbanti
Poiché la psoriasi è una malattia cronica caratterizzata da periodi di remissione alternati a fasi di riacutizzazione, che riconosce fattori scatenanti, è importante evitare abitudini e comportamenti che possano aggravare o indurre una ripresa della malattia[43].
Traumatismi
- Trauma locale (fenomeno di Koebner; psoriasi a placche)
- Irritazione (variante del Fenomeno di Koebner; psoriasi a placche)
- Scottatura solare o da UV (psoriasi a placche)
Infezioni
- Candida albicans
- Viremia (psoriasi guttata)
- Streptococco A-emolitico (psoriasi guttata)
- Infezioni delle alte vie respiratorie (psoriasi guttata nel bambino)
Farmaci
- Terapia antimalarica con clorochina
- Somministrazione di litio, interferone, beta-bloccanti, ACE-inibitori, indometacina, sali d’oro, salicilati
- Reazioni allergiche a farmaci
- Ritiro della terapia corticosteroide[non chiaro]
Altri
Clinica
Forme
Esistono varie forme di psoriasi:
- nummulare (a moneta), la più diffusa
- a placche
- guttata, produce poche squame
- invertita, poiché i sintomi hanno collocazione opposta (superfici flessorie delle articolazioni) rispetto alle forme più comuni
Segni e sintomi
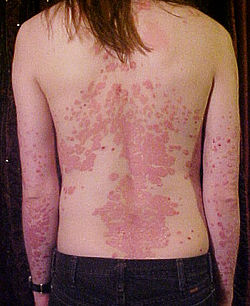
Le manifestazioni più comuni sono papule e placche eritematose ben delimitate ricoperte di scaglie argentee o opalescenti. Le lesioni sono di varie dimensioni e la severità può variare da pochi punti di desquamazione di tipo forforoso a dermatosi generali con artrite (artrite psoriasica), esfoliazioni ed eruzioni debilitanti. Nonostante il nome significhi "condizione pruriginosa" il prurito non è sempre presente; in alcuni casi tale sintomo è presente nelle vulviti psoriasiche dove le lesioni da grattamento possono essere simili a quelle da lichen simplex[46]
I siti più comuni per le lesioni sono lo scalpo (inclusa la zona retroauricolare), le zone di estensione di gomito e ginocchio e la zona lombo-sacrale, ma in alcune sue forme si trova nelle zone di flessione, sui genitali e sulla pianta dei piedi e il palmo delle mani. Le lesioni guariscono senza lasciare cicatrici e senza disturbare la crescita dei peli.
Il 30-50% dei soggetti presenta degenerazioni delle unghie, con ipercheratosi, ispessimento, detrito subunguale, onicolisi, distorsione. Nella fase eruttiva un trauma può causare la comparsa di lesioni lineari (Fenomeno di Koebner).
Trattamento
Terapia locale
La terapia della psoriasi deve essere personalizzata e include come farmaci di prima scelta nelle forme a estensione limitata, preparazioni topiche emollienti come la vaselina, cortisoniche e/o agenti riduttori (catrame o ditranolo), agenti cheratolitici (acido salicilico e/o urea ) e analoghi della vitamina D.
Tra le terapie locali può essere annoverata l'ittioterapia.
Terapia sistemica
Nel caso di forme generalizzate di psoriasi, a volte si ricorre a terapie sistemiche. Queste includono fototerapia con UVB, oppure con UVA e psoraleni (fotochemioterapia o PUVA terapia).
Possono essere utilizzati anche retinoidi (acitretina e etretinato), o ciclosporina A.
Da una meta-analisi compiuta pochi anni fa sui risultati delle terapie sistemiche in caso di psoriasi a placche severa, sembra che i migliori risultati siano ottenuti con la fotochemioterapia, seguita dal trattamento UVB e poi dagli altri trattamenti. Gli effetti collaterali sono particolarmente frequenti con l’utilizzo dei retinoidi, e sono soprattutto di carattere muco-cutaneo. Tutti questi trattamenti, in particolare quelli sistemici, comportano certi rischi di tossicità, in quanto il rischio di insorgenza di tumori cutanei aumenta nei soggetti sottoposti a tale terapia. Trattamenti con derivati della vitamina A (retinolo) vanno utilizzati solo in ambienti altamente specializzati e sotto stretto controllo medico.
Oltre a questi diversi tipi di farmaci, se la manifestazione di psoriasi è lieve è possibile utilizzare delle creme idratanti atte ad idratare e ridurre la desquamazione della pelle. Inoltre i pazienti colpiti da psoriasi hanno bisogno di un'esposizione al sole, chiaramente non prolungata, utilizzando creme solari consigliate da un dermatologo.
Farmaci biologici
I farmaci biologici rappresentano uno dei maggiori progressi ottenuti dalla medicina negli ultimi anni in campo terapeutico.
Il successo di queste nuove terapie risiede nella loro grande selettività d'azione che consente di ottenere, nella maggior parte dei casi, una notevole efficacia terapeutica in tempi brevi con riduzione degli effetti collaterali rispetto alle terapie tradizionali di tipo "chimico".
I farmaci biologici finora prodotti sono anticorpi monoclonali, citochine (interferoni e interleuchine), proteine di fusione e fattori di crescita tissutali.
Tali prodotti possiedono l'enorme vantaggio di poter interferire in modo selettivo, a vari livelli e con modalità di azione differenti, nei processi immunologici che scatenano e sostengono la psoriasi perché, come è ormai noto da anni, nello sviluppo della psoriasi sono coinvolte sia cellule proprie della cute, quali i cheratociti, sia cellule del sangue destinate alla difesa immunitaria, come i linfociti T.
L'alterazione di un fisiologico "dialogo" fra questi due tipi di cellule dà luogo a uno squilibrio nella sintesi dei prodotti dei linfociti T, con abnorme produzione di una serie di molecole di interazione cellulare che porta a eritema e formazione di squame.
I farmaci biologici registrati dall'EMEA verranno monitorati, nell'ambito del progetto "PsoCare", da centri di riferimento, per verificarne la tollerabilità, l'efficienza e l'efficacia a lungo termine.
Le molecole maggiormente studiate sono: l'etanercept, l'efalizumab, l'infliximab, l'adalimumab, l'alefacept e l'ustekinumab.
Etanercept
L'etanercept è una proteina di fusione ottenuta tramite tecniche di DNA ricombinante del recettore umano p75 del fattore TNF-alfa con la frazione Fc dell’immunoglobulina umana IgG1. La proteina funziona da recettore solubile per il TNF-alfa e possiede un'affinità di legame per il TNF-alfa più alta di quella degli altri recettori solubili. Il farmaco viene somministrato con punture sottocutanee. L'etanercept, registrato all'EMEA (Agenzia europea per i medicinali), è un farmaco indicato per la psoriasi, l'artrite psoriasica, l'artrite reumatoide e la spondilite anchilosante.
Efalizumab
L'efalizumab è un anticorpo monoclonale umanizzato ricombinante che lega specificatamente un'importante molecola di adesione dei linfociti T, fondamentale in tre processi chiave nella genesi della psoriasi, quali il legame dei linfociti ad altre cellule, la migrazione dal sangue al derma e l’attivazione delle cellule T, che conduce al rilascio delle citochine infiammatorie e alla proliferazione dei cheratinociti. Questo farmaco è stato registrato all'EMEA, indicato per la psoriasi e somministrato con punture sottocutanee. L'efalizumab è stato bloccato e sospeso dall'EMEA nel febbraio 2009 per elevata tossicità e scarsa efficacia[47][48].
Infliximab
L'infliximab è un anticorpo monoclonale che si lega con alta specificità e affinità sia alla forma solubile sia a quella trans-membrana del Tumor Necrosis Factor (TNF-alfa), inibendone l'attività. Il TNF- alfa è una citochina pro-infiammatoria presente ad alti livelli nelle lesioni psoriasiche e nella sinovia articolare di pazienti con artrite psoriasica. Numerose evidenze dimostrano che esiste una correlazione fra la gravità della patologia cutanea e l'aumentata concentrazione di TNF-alfa nel siero. L'infliximab pertanto agisce riducendo l'infiammazione e l'iperproliferazione rispettivamente dell'eritema e della formazione della squama. Attualmente in Italia è stato approvato nella terapia dell’artrite reumatoide, del morbo di Crohn, della spondilite anchilosante, per l'artrite psoriasica e per la psoriasi. La somministrazione del farmaco avviene per via endovenosa.
Adalimumab
L'adalimumab è un anticorpo monoclonale che ha come target il TNF-alfa che si somministra per via sottocutanea in preparazione liquida alla dose di 40 mg ogni due settimane.
Come tutti gli anti TNF-alfa possiede una grande selettività d'azione, cioè è in grado di agire solo sull'attività della molecola, senza interferire con altri sistemi dell’organismo. L'utilizzo per la psoriasi non è ancora approvato.
Alefacept
L'alefacept è una proteina di fusione umana LFA-3/IgG1 che agisce bloccando l’interazione tra le cellule che presentano l’antigene e i linfociti T. Sebbene da poco approvato dalla Food and Drug Administration (FDA), tale farmaco non ha ricevuto l'approvazione dall'autorità europea EMEA per cui saranno necessari ulteriori studi per una definitiva commercializzazione in Europa.
Ustekinumab
L'ustekinumab è un anticorpo monoclonale IgGk1 interamente umano, che lega interleuchina 12 e 23, approvato per la psoriasi a placche sia da FDA che da EMEA[49]; si è dimostrato efficace anche nell'artropatia psoriasica e nel morbo di Crohn[50]. Si somministra per via sottocutanea in dosaggio da 45 mg per individui con peso inferiore o uguale a 100 kg e 90 mg per individui con peso superiore a 100 kg ogni 12 settimane.
Prevenzione
Esistono norme igienico-comportamentali che possono ridurre l'entità delle manifestazioni cutanee[43]:
- evitare di grattare le lesioni o strofinare la pelle bagnata, in quanto questo aumenta l’infiltrazione;
- limitare l'uso di detergenti per l’igiene personale che favoriscono la desquamazione;
- mantenere una buona idratazione;
- evitare l'esposizione al sole, specialmente nelle ore più calde;
- evitare di indossare capi d'abbigliamento irritanti, quali vestiti in lana o fibre sintetiche;
- evitare il contatto prolungato con l'acqua, che può favorire lo sviluppo di infezioni batteriche;
- evitare gli aumenti ponderali[44];
- adottare norme alimentari specifiche (consumare preferibilmente pasta, pasta integrale, riso, legumi, pesce e verdure “amare“ come cicoria, radicchio, crescione e zucca amara; evitare cibi “calorigeni“, melanzane, pomodori crudi, peperoni crudi e cotti, carciofi, frutti di bosco, mele crude e cachi).[senza fonte]
Note
- ^ A. Shai, [Psoriasis, biblical afflictions and patients' dignity]., in Harefuah, vol. 141, n. 5, May 2002, pp. 479-82, 496, PMID 12073533.
- ^ L. Nardelli, [Psoriasis in the history of medicine]., in G Ital Dermatol, vol. 100, Lug-Ago 1959, pp. 363-88, PMID 14426024.
- ^ LK. Eckes, [Psoriasis and leprosy in the light of common history. A contribution on epidemiology and differential diagnosis]., in Hautarzt, vol. 29, n. 6, Jun 1978, pp. 331-6, PMID 350808.
- ^ A. Lyell, Leprosy and psoriasis., in J Am Acad Dermatol, vol. 16, 3 Pt 1, Mar 1987, pp. 620-2, PMID 3546422.
- ^ FO. Meenan, A note on the history of psoriasis., in Ir J Med Sci, n. 351, Mar 1955, pp. 141-2, PMID 14353580.
- ^ FS. Glickman, Lepra, psora, psoriasis., in J Am Acad Dermatol, vol. 14, 5 Pt 1, May 1986, pp. 863-6, PMID 3519699.
- ^ K. Holubar, Psoriasis--100 years ago., in Dermatologica, vol. 180, n. 1, 1990, pp. 1-4, PMID 1968402.
- ^ B. Gordon, Mercury absorption and psoriasis., in Br Med J, vol. 2, n. 5003, Nov 1956, pp. 1202-6, PMID 13364416.
- ^ F. Kern, Ammoniated mercury ointment as a cause of peripheral neuropathy., in Dermatologica, vol. 183, n. 4, 1991, pp. 280-2, PMID 1667099.
- ^ a b EM. Farber, History of the treatment of psoriasis., in J Am Acad Dermatol, vol. 27, n. 4, Oct 1992, pp. 640-5, PMID 1401327.
- ^ JR. Sorenson, Treatment of rheumatoid and degenerative diseases with copper complexes: a review with emphasis on copper-salicylate., in Inflammation, vol. 2, n. 3, Sep 1977, pp. 217-38, PMID 367963.
- ^ Henry G. Piffard, "A Treatise On The Materia Medica And Therapeutics Of The Skin", Sampson Low, Marston, Searle & Rivington, 1881.
- ^ Smith ML. Environmental and sports-related skin diseases. In: Bolognia, JL, et al., eds. Dermatology. 2nd ed. London: Mosby, 2008: 1364
- ^ RA. Schwartz, Arsenic and the skin., in Int J Dermatol, vol. 36, n. 4, Apr 1997, pp. 241-50, PMID 9169318.
- ^ B. Lindelöf, Grenz ray therapy in dermatology. An experimental, clinical and epidemiological study., in Acta Derm Venereol Suppl (Stockh), vol. 132, 1987, pp. 1-67, PMID 3481149.
- ^ B. Lindelöf, [Grenz ray therapy]., in Hautarzt, vol. 40, n. 1, Jan 1989, pp. 4-7, PMID 2646248.
- ^ a b H. Takahashi, Analysis of psoriasis patients registered with the Japanese Society for Psoriasis Research from 2002-2008., in J Dermatol, vol. 38, n. 12, Dec 2011, pp. 1125-9, DOI:10.1111/j.1346-8138.2010.01145.x, PMID 21951304.
- ^ C. Bonifati, Recognition and treatment of psoriasis. Special considerations in elderly patients., in Drugs Aging, vol. 12, n. 3, Mar 1998, pp. 177-90, PMID 9534019.
- ^ MA. de Rie, Overview of psoriasis., in Dermatol Ther, vol. 17, n. 5, 2004, pp. 341-9, DOI:10.1111/j.1396-0296.2004.04037.x, PMID 15379769.
- ^ A. Kawada, A survey of psoriasis patients in Japan from 1982 to 2001., in J Dermatol Sci, vol. 31, n. 1, Feb 2003, pp. 59-64, PMID 12615365.
- ^ JM. Gelfand, Prevalence and treatment of psoriasis in the United Kingdom: a population-based study., in Arch Dermatol, vol. 141, n. 12, Dec 2005, pp. 1537-41, DOI:10.1001/archderm.141.12.1537, PMID 16365254.
- ^ L. Naldi, Study design and preliminary results from the pilot phase of the PraKtis study: self-reported diagnoses of selected skin diseases in a representative sample of the Italian population., in Dermatology, vol. 208, n. 1, 2004, pp. 38-42, DOI:10.1159/000075044, PMID 14730235.
- ^ R. Parisi, Global Epidemiology of Psoriasis: A Systematic Review of Incidence and Prevalence., in J Invest Dermatol, Sep 2012, DOI:10.1038/jid.2012.339, PMID 23014338.
- ^ a b V. Chandran, Geoepidemiology and environmental factors of psoriasis and psoriatic arthritis., in J Autoimmun, vol. 34, n. 3, May 2010, pp. J314-21, DOI:10.1016/j.jaut.2009.12.001, PMID 20034760.
- ^ R. Zenz, Psoriasis-like skin disease and arthritis caused by inducible epidermal deletion of Jun proteins., in Nature, vol. 437, n. 7057, Sep 2005, pp. 369-75, DOI:10.1038/nature03963, PMID 16163348.
- ^ R. de Cid, Deletion of the late cornified envelope LCE3B and LCE3C genes as a susceptibility factor for psoriasis., in Nat Genet, vol. 41, n. 2, Feb 2009, pp. 211-5, DOI:10.1038/ng.313, PMID 19169253.
- ^ MA. Gupta, Some psychosomatic aspects of psoriasis., in Adv Dermatol, vol. 5, 1990, pp. 21-30; discussion 31, PMID 2204373.
- ^ RP. Dellavalle, Do smoking, obesity, and stress cause psoriasis?, in J Invest Dermatol, vol. 125, n. 1, Jul 2005, pp. vi-vii, DOI:10.1111/j.0022-202X.2005.23792.x, PMID 15982291.
- ^ L. Naldi, Cigarette smoking, body mass index, and stressful life events as risk factors for psoriasis: results from an Italian case-control study., in J Invest Dermatol, vol. 125, n. 1, Jul 2005, pp. 61-7, DOI:10.1111/j.0022-202X.2005.23681.x, PMID 15982303.
- ^ DC. ABELE, HEREDITY AND PSORIASIS. STUDY OF A LARGE FAMILY., in Arch Dermatol, vol. 88, Jul 1963, pp. 38-47, PMID 14042660.
- ^ W. Watson, The genetics of psoriasis., in Arch Dermatol, vol. 105, n. 2, Feb 1972, pp. 197-207, PMID 5060862.
- ^ V. Chandran, Familial aggregation of psoriatic arthritis., in Ann Rheum Dis, vol. 68, n. 5, May 2009, pp. 664-7, DOI:10.1136/ard.2008.089367, PMID 18524791.
- ^ FO. Nestle, Psoriasis., in N Engl J Med, vol. 361, n. 5, Jul 2009, pp. 496-509, DOI:10.1056/NEJMra0804595, PMID 19641206.
- ^ AM. Bowcock, Genetics of psoriasis: the potential impact on new therapies., in J Am Acad Dermatol, vol. 49, 2 Suppl, Aug 2003, pp. S51-6, PMID 12894126.
- ^ A. Pasić, The genetics of psoriasis--selected novelties in 2008., in Acta Dermatovenerol Croat, vol. 17, n. 3, 2009, pp. 176-81, PMID 19818216.
- ^ LD. Sun, Evidence for a novel psoriasis susceptibility locus at 9q33-9q34 in Chinese Hans., in J Invest Dermatol, vol. 127, n. 5, May 2007, pp. 1140-4, DOI:10.1038/sj.jid.5700671, PMID 17205061.
- ^ RO. Leder, Familial psoriasis and HLA-B: unambiguous support for linkage in 97 published families., in Hum Hered, vol. 48, n. 4, pp. 198-211, PMID 9694251.
- ^ M. Cargill, A large-scale genetic association study confirms IL12B and leads to the identification of IL23R as psoriasis-risk genes., in Am J Hum Genet, vol. 80, n. 2, Feb 2007, pp. 273-90, DOI:10.1086/511051, PMID 17236132.
- ^ RP. Nair, Polymorphisms of the IL12B and IL23R genes are associated with psoriasis., in J Invest Dermatol, vol. 128, n. 7, Jul 2008, pp. 1653-61, DOI:10.1038/sj.jid.5701255, PMID 18219280.
- ^ JE. Gudjonsson, Genetic variation and psoriasis., in G Ital Dermatol Venereol, vol. 143, n. 5, Oct 2008, pp. 299-305, PMID 18833071.
- ^ CT. Jordan, Rare and common variants in CARD14, encoding an epidermal regulator of NF-kappaB, in psoriasis., in Am J Hum Genet, vol. 90, n. 5, May 2012, pp. 796-808, DOI:10.1016/j.ajhg.2012.03.013, PMID 22521419.
- ^ CT. Jordan, PSORS2 is due to mutations in CARD14., in Am J Hum Genet, vol. 90, n. 5, May 2012, pp. 784-95, DOI:10.1016/j.ajhg.2012.03.012, PMID 22521418.
- ^ a b Pharmamedix: Psoriasi
- ^ a b Naldi L., Rebora A., Dermatologia basata sulle prove di efficacia, 2006, Masson
- ^ Le sigarette bruciano anche la pelle - Corriere.it
- ^ Malattie a carattere desquamativo
- ^ Raccomandazione EMEA su base della NOTA INFORMATIVA dell'AIFA
- ^ PHARMASTAR - L'Emea raccomanda la sospensione dell'antipsoriasi Efalizumab
- ^ Approvazione di Ustekinumab nel trattamento della psoriasi a placche da moderata a grave
- ^ Benson JM, Peritt D, Scallon BJ, et al., Discovery and mechanism of ustekinumab: a human monoclonal antibody targeting interleukin-12 and interleukin-23 for treatment of immune-mediated disorders, in MAbs, vol. 3, n. 6, 2011, pp. 535–45, DOI:10.4161/mabs.3.6.17815.
Voci correlate
Altri progetti
- Wikimedia Commons contiene immagini o altri file sulla Psoriasi
Collegamenti esterni
- Psoriasis International
- Psoriasisonline sito della rivista scientifica Psoriasis
- Fondazione Cesare Serono
- Registro PSOCARE presso AIFA
- What is psoriasis? American Academy of Family Physicians, luglio 1995, revisionata/aggiornata ottobre 2008
- Associazione Nazionale per la tutela del malato di Psoriasi e Vitiligine
- Associazione per la Difesa degli Psoriasici
- Associazione malati di psoriasi
- Federazione Italiana della Psoriasi