Benzaldeide
La benzaldeide è un'aldeide aromatica avente formula molecolare C6H5−CHO, o anche Ph−CHO.[2] La sua molecola può essere considerata come un benzene in cui uno degli atomi di idrogeno è sostituito da un formile, gruppo che caratterizza le aldeidi.[3] Tale composto è il più semplice membro della categoria delle aldeidi aromatiche,[4] nonché quello più sfruttato a livello industriale.
| Benzaldeide | |
|---|---|
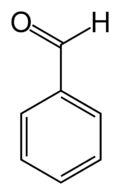 | |
| Nome IUPAC | |
| Benzencarbaldeide | |
| Abbreviazioni | |
| Ph-CHO | |
| Nomi alternativi | |
| Fenilmetanale Aldeide benzoica | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C7H6O |
| Massa molecolare (u) | 106,13 |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 202-860-4 |
| PubChem | 240 |
| SMILES | C1=CC=C(C=C1)C=O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,0415 |
| Solubilità in acqua | 6 g/l (20 °C) |
| Temperatura di fusione | −26 °C (247 K) |
| Temperatura di ebollizione | 178 °C (451 K) (1013 hPa) |
| Indicazioni di sicurezza | |
| Punto di fiamma | 64 °C (337 K) |
| Limiti di esplosione | 1,4 - 8,5 Vol% |
| Temperatura di autoignizione | 190 °C (463 K) |
| Simboli di rischio chimico | |

| |
| attenzione | |
| Frasi H | 302 - 332 - 319 - 335 |
| Consigli P | 280 - 301+330 [1] |
In natura si trova un suo precursore, l'amigdalina, un glucoside che per idrolisi dà acido cianidrico, glucosio o altri zuccheri e che è presente nelle mandorle amare (es: nell'olio di mandorle) o in particolari semi[4][5] tra cui dell'albicocca e delle pesche.[5]
Benché la benzaldeide si trovi già in natura, si preferisce produrla in laboratorio.[4]
A temperatura ambiente si presenta come un liquido incolore volatile, o giallo pallido se impura,[5] con un piacevole e caratteristico odore di mandorle amare:[5] la benzaldeide è infatti un importante componente dell'aroma di mandorla.
Poco solubile in acqua (0,345 g / 100 g), essa è invece completamente miscibile con alcool, etere e solfolano; è inoltre molto solubile in etere di petrolio, benzene e acetone, ma anche in ammoniaca liquida e in acido fluoridrico anidro.[6]
La benzaldeide può essere ottenuta da diverse fonti naturali fra cui l'albicocca, la ciliegia, le foglie di alloro e, in forma combinata di glicoside (amigdalina), dai semi di diverse piante (es: pesco, mandorlo). Oggigiorno la maggior parte della benzaldeide viene ottenuta per via sintetica per ossidazione del toluene.
Produzione
modificaLa benzaldeide può essere preparata ricorrendo a diversi processi chimici. Attualmente i metodi più utilizzati prevedono la clorurazione oppure l'ossidazione del toluene in fase liquida. Esistono tuttavia altre vie sintetiche per lo più abbandonate a livello industriale fra cui: l'ossidazione parziale dell'alcol benzilico (Ph−CH2OH), il trattamento con basi (es: NaOH) del cloruro di benzale (Ph−CHCl2), oppure la reazione fra benzene e monossido di carbonio.
Reazioni
modificaLe reazioni più comuni della benzaldeide includono, ad esempio, l'ossidazione con conseguente formazione di acido benzoico. È possibile ottenere alcol benzilico a partire dalla benzaldeide tramite idrogenazione. Facendo invece reagire la benzaldeide con acetato di sodio anidro e anidride acetica si ottiene l'acido cinnamico, la sostanza responsabile dell'aroma della cannella. Una soluzione alcolica di cianuro di potassio è invece utilizzabile per catalizzare la condensazione benzoinica della benzaldeide a dare il benzoino (2-idrossi-2-fenilacetofenone).
In presenza di una soluzione alcolica e di una base come l'idrossido di potassio la benzaldeide può anche dare la reazione di Cannizzaro, grazie alla quale si ha riduzione di una molecola dell'aldeide a dare un alcol (alcol benzilico) e simultaneamente ossidazione con formazione di un sale di un acido carbossilico (benzoato di potassio). Genericamente per le aldeidi aromatiche la velocità di questa reazione è strettamente legata al tipo di sostituenti presenti sull'anello aromatico.
Usi
modificaSebbene la benzaldeide possa essere impiegata come solvente, il suo principale utilizzo è quello di precursore per la sintesi di diversi composti organici, dai farmaci agli additivi per le plastiche[7]. È anche un importante intermedio per la preparazione di profumi[5][7] e fragranze come anche nella sintesi di coloranti[7] anilinici.
Note
modifica- ^ scheda della benzaldeide su IFA-GESTIS Archiviato il 16 ottobre 2020 in Internet Archive.
- ^ Daniel R. Bloch, Organic Chemistry Demystified, McGraw-Hill, 2006, p. 359, ISBN 0-07-148710-7.
- ^ Paula Yurkanis Bruice, Organic chemistry, Seventh edition, Pearson, 2014, p. 791, ISBN 978-0-321-80322-1.
- ^ a b c Definizione su sapere.it, su sapere.it. URL consultato il 17 giugno 2011 (archiviato il 5 febbraio 2011).
- ^ a b c d e definizione sull'enciclopedia Treccani online, su treccani.it. URL consultato il 17 giugno 2011 (archiviato il 15 dicembre 2012).
- ^ benzaldehyde, su chemister.ru. URL consultato il 2 maggio 2025.
- ^ a b c Definizione su un'enciclopedia online del Corriere della Sera, su dizionari.corriere.it. URL consultato il 17 giugno 2011 (archiviato il 18 febbraio 2011).
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su benzaldeide
Collegamenti esterni
modifica- benzaldeide, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- (EN) William H. Brown, benzaldehyde, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | LCCN (EN) sh85013226 · GND (DE) 4144489-9 · J9U (EN, HE) 987007283270305171 |
|---|