Cloruro di molibdeno(V)
Il cloruro di molibdeno(V) o pentacloruro di molibdeno è il composto binario con formula MoCl5, dove il molibdeno è nello stato di ossidazione +5. In condizioni normali MoCl5 è un solido di colore molto scuro descritto variamente come nero,[3] blu scuro,[1] o verde scuro.[2][4] È il più importante alogenuro di molibdeno, base di partenza per la sintesi di composti organometallici di molibdeno.[4]
| Cloruro di molibdeno(V) | |
|---|---|
 | |
| Nome IUPAC | |
| Cloruro di molibdeno(V), pentacloruro di molibdeno | |
| Caratteristiche generali | |
| Formula bruta o molecolare | Cl5Mo |
| Massa molecolare (u) | 273,21 |
| Aspetto | solido blu scuro[1] |
| Numero CAS | |
| Numero EINECS | 233-575-3 |
| PubChem | 61497 |
| SMILES | Cl[Mo](Cl)(Cl)(Cl)Cl |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 2,928[1] |
| Solubilità in acqua | reazione violenta |
| Temperatura di fusione | 194 °C (467 K)[1] |
| Temperatura di ebollizione | 268 °C (541 K)[1] |
| Proprietà termochimiche | |
| ΔfG0 (kJ·mol−1) | -528 kJ/mol[2] |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| pericolo | |
| Frasi H | 314 [1] |
| Consigli P | 280 - 305+351+338 - 310 - 314 [1] |
Storia
modificaIl composto fu probabilmente osservato già da Jöns Jacob Berzelius nel 1825 e quindi da Christian Wilhelm Blomstrand nel 1857, ma fu ottenuto puro e caratterizzato solo da L. Paul Liechti e Bernhard Kempe nel 1873.[5]
Struttura molecolare
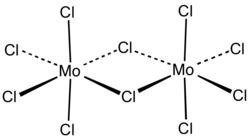
modificaAllo stato solido il pentacloruro di molibdeno ha una struttura dimera Mo2Cl10, come si osserva negli analoghi Nb2Cl10 e Ta2Cl10, che appartengono al gruppo precedente della tavola periodica.[3][6]
I cristalli hanno struttura monoclina, gruppo spaziale C2/m, con costanti di reticolo a = 1731 pm, b = 1781 pm, c = 607,9 pm, β = 95,7°, con 12 unità di formula MoCl5 per cella elementare.[7]
Allo stato gassoso sono invece stati osservati monomeri MoCl5 presenti principalmente nelle due diverse configurazioni di piramide a base quadrata e bipiramide trigonale, con rispettive simmetrie C4v e D3h.[8] Le specie monomeriche hanno un elettrone spaiato e sono paramagnetiche,
Sintesi
modificaIl composto si ottiene per reazione diretta in condizioni controllate, curando di rimuovere tracce di ossigeno e di ossidi superficiali dal molibdeno metallico.[5][9]
Reattività
modificaMoCl5 è un composto molto reattivo, che si idrolizza rapidamente in presenza di umidità rilasciando acido cloridrico e ossicloruri di molibdeno(V) come MoOCl3. La reazione in acqua è violenta. Si scioglie invece senza decomporsi in solventi come etere dietilico, tetracloruro di carbonio e disolfuro di carbonio.[9]
Con acetonitrile MoCl5 si riduce formando [MoCl4(CH3CN)2], un composto molto utile per la sintesi di altri complessi di molibdeno(IV) dato che il legante acetonitrile è labile.[10]
Trattando MoCl5 con bromuro di idrogeno si può ottenere il bromuro di molibdeno(IV):[11]
MoCl5 è un buon acido di Lewis; con anioni cloruro si forma la specie ottaedrica [MoCl6]−.[2][6]
Tossicità / Indicazioni di sicurezza
modificaIl composto va maneggiato con tecniche particolari in atmosfera inerte, dato che reagisce con umidità e acqua rilasciando HCl e prodotti secondari, e risulta quindi fortemente corrosivo.
Note
modificaBibliografia
modifica- (EN) G. Brauer, Handbook of preparative inorganic chemistry, vol. 2, 2ª ed., New York, Academic Press, 1965.
- (EN) J. Brunvoll, A. A. Ischenko, V. P. Spiridonov e T. G. Strand, Composition and Molecular Structure of Gaseous Molybdenum Pentachloride by Electron Diffraction, in Acta Chem. Scand., 38A, 1984, pp. 115-120, DOI:10.3891/acta.chem.scand.38a-0115.
- (EN) F. Calderazzo, C. Maichle-Mössmer, G. Pampaloni e J. Strähle, Low-temperature syntheses of vanadium(III) and molybdenum(IV) bromides by halide exchange, in J. Chem. Soc., Dalton Trans., 1993, pp. 655-658, DOI:10.1039/DT9930000655.
- (EN) J. R. Dilworth e R. L. Richards, The Synthesis of Molybdenum and Tungsten Dinitrogen Complexes, in Inorg. Synth., vol. 28, 1990, pp. 33-43, DOI:10.1002/9780470132593.ch7.
- GESTIS, Molybdenum(V) chloride, su gestis.dguv.de. URL consultato il 10 aprile 2025. Pagina del composto nel data base GESTIS.
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (DE) A. F. Holleman e N. Wiberg, Lehrbuch der Anorganischen Chemie, Berlino, Walter de Gruyter, 2007, ISBN 978-3-11-017770-1.
- (EN) C. E. Housecroft e A. G. Sharpe, Inorganic chemistry, 5ª ed., Harlow (England), Pearson Education Limited, 2018, ISBN 978-1-292-13414-7.
- (DE) L. P. Liechti e B. Kempe, Ueber die Chloride des Molybdäns, in Justus Liebigs Annalen der Chemie, vol. 169, n. 3, 1873, pp. 344-359, DOI:10.1002/jlac.18731690303.
- (EN) D. E. Sands e A. Zalkin, The crystal structure of MoCl5, in Acta Crystallographica, vol. 12, n. 10, 1959, pp. 723–726, DOI:10.1107/s0365110x59002146.
- (EN) R. F. Sebenik, A. R. Burkin, R. R. Dorfler e altri, Molybdenum and Molybdenum Compounds, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, DOI:10.1002/14356007.a16_655.
Altri progetti
modifica- Wikimedia Commons contiene immagini o altri file su cloruro di molibdeno(V)