Nabiximols
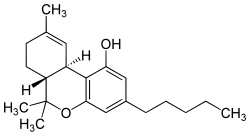
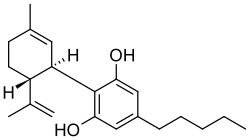
Il Nabiximols è una miscela di due cannabinoidi: il delta-9-tetraidrocannabinolo (THC) e il cannabidiolo (CBD).[1] La formula generale è C42H60O4[2] e in condizioni normali si presenta come un semisolido viscoso di colore brunastro dal caratteristico odore di cannabis.[1]
| Nabiximols | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| (6aR,10aR)-6,6,9-trimetil-3-pentil-6a,7,8,10a-tetraidro-6H-benzo[c]cromen-1-ol - 2-[(1R,6R)-6-isopropenil-3-metil-3-cicloesen-1-il]-5-pentil-1,3-benzenediolo (1:1) | |
| Nomi alternativi | |
| Sativex®, GW 1000, SAB 378, Cannador, Tetranabinex, Nabidiolex | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C21H30O2 (THC) C21H30O2 (CBD) |
| Massa molecolare (u) | 628,9 g/mol |
| Numero CAS | |
| Codice ATC | N02 |
| PubChem | 44148067 |
| DrugBank | DBDB14011 |
| SMILES | CCCCCC1=CC(=C(C(=C1)O)C2C=C(CC[C@H]2C(=C)C)C)O.CCCCCC1=CC(=C2[C@@H]3C=C(CC[C@H]3C(OC2=C1)(C)C)C)O |
| Proprietà chimico-fisiche | |
| Costante di dissociazione acida (pKa) a {{{Ka_temperatura}}} K | 9.34 |
| Solubilità in acqua | 0,0126 mg/mL |
| Coefficiente di ripartizione 1-ottanolo/acqua | 6.1 |
| Dati farmacologici | |
| Categoria farmacoterapeutica | analgesico cannabinoide |
| Modalità di somministrazione | spray orale |
| Dati farmacocinetici | |
| Emivita | ≈100 minuti |
| Indicazioni di sicurezza | |
Storia
modificaÈ stato sviluppato da GW Pharmaceuticals e nel giugno 2010 venne approvata come preparato vegetale nel Regno Unito.[3] Nel 2011, GW concesse a Novartis la licenza per la sua commercializzazione in Asia (esclusi Cina e Giappone), Africa e Medio Oriente.[4] È stato il primo prodotto contenente derivati della cannabis ad essere approvato in Australia, nel 2012.[5]
L'utilizzo di nabiximols è approvato in: Spagna[6], Repubblica Ceca[7], Germania[8], Danimarca[9], Svezia[10], Canada[11][12], Svizzera[13], Paesi Bassi[14], Belgio[15], Austria[16], Finlandia[17], Norvegia[18], Francia[19], Portogallo[20], Grecia[21], Ungheria[22], Polonia[23], Israele[24], Slovenia[25], e altri Paesi.
Il farmaco è stato autorizzato all'immissione in commercio in Italia (G.U. n. 100 del 30 aprile 2013 S.O.) e, per le indicazioni terapeutiche autorizzate, deve essere impiegato il medicinale registrato in Italia, mentre per le specialità Bedrocan, Bedrobinol, Bediol e Bedica, l'Ufficio Centrale Stupefacenti continua ad accettare le richieste di importazione con la procedura prevista dal DM 11 febbraio 1997.[26]
Caratteristiche strutturali e fisiche
modificaPresenta le seguenti caratteristiche:[2]
- 3 donatori di legami a idrogeno
- 4 accettori di legami a idrogeno
- 10 legami ruotabili
- 4 elementi stereogenici
- 46 atomi pesanti
- massa monoisotopica = 628.44916039 Da
- superficie polare = 69.9 Ų
Sintesi
modificaTHC e CBD sono estratti parzialmente purificati dalla Cannabis sativa L., coltivata specificamente per produrre i due chemiotipi.[1]
Reattività e caratteristiche chimiche
modificaTHC e CBD risultano insolubili in acqua e solubili nella maggior parte dei solventi organici.[1]
Farmacologia e tossicologia
modificaFarmacocinetica
modificaAssorbimento
modificaSia THC che CBD vengono assorbiti abbastanza rapidamente dopo l’assunzione di Sativex e compaiono nel plasma entro 15 minuti dalla somministrazione di una singola dose oromucosale. Con Sativex, un valore medio di Cmax di circa 4 ng/ml è stato raggiunto dopo 45 - 120 minuti dalla somministrazione di una singola dose di 10,8 mg di THC e il farmaco è risultato generalmente ben tollerato con scarsa evidenza di significativa psicoattività. Quando è somministrato con il cibo il valore medio della Cmax e della AUC per il THC era di 1,6 e 2,8 volte superiore rispetto alla somministrazione a digiuno. I valori corrispondenti per il CBD sono aumentati di 3,3 e 5,1 volte.[27]
Distribuzione
modificaI cannabinoidi sono estremamente lipofili e come tali vengono velocemente assorbiti e distribuiti nel grasso corporeo. Le relative concentrazioni nel sangue in seguito alla somministrazione oromucosale di Sativex sono più basse di quelle registrate in seguito all’inalazione della stessa dose di THC in quanto il processo di assorbimento è più lento e la ridistribuzione nei tessuti adiposi è rapida.[27]
Inoltre parte del THC viene metabolizzata durante il primo passaggio attraverso il fegato (metabolismo epatico di primo passaggio) e convertito in 11-OH-THC, il primo metabolita del THC che subisce quindi l’ulteriore ossidazione in 11- nor-9-COOH-THC, il metabolita più abbondante del THC; in maniera simile il CBD viene trasformato in 7-OH-CBD.
Il THC presenta un elevato legame proteico (~97%). THC e CBD possono essere conservati anche fino a quattro settimane nei tessuti adiposi dai quali vengono lentamente rilasciati a livelli sottoterapeutici nel circolo ematico e quindi metabolizzati ed eliminati attraverso l’urina e le feci.[27]
Metabolismo
modificaTHC e CBD vengono metabolizzati nel fegato dal sistema enzimatico del citocromo P450.
L’isoenzima del citocromo epatico P450 2C9 catalizza la formazione di 11-OH-THC, il metabolita primario, che viene ulteriormente metabolizzato dal fegato e convertito in altri composti quali 11-nor-carbossi-Δ9-THC (THC-COOH), il metabolita umano più abbondante nel plasma e nell’urina. La sottofamiglia P450- 3A catalizza la formazione di altri metaboliti idrossilati minori.
Il CBD viene estensivamente metabolizzato ed oltre 33 metaboliti sono stati identificati nell’urina. Il principale percorso metabolico è rappresentato da idrossilazione e ossidazione in C-7 seguite da un’ulteriore idrossilazione nei gruppi pentilico e propenilico. Il principale metabolita ossidato individuato è l’acido CBD-7-oico contenente una catena laterale idrossietilica.[27]
Eliminazione
modificaDa studi clinici condotti con Sativex, un’analisi farmacocinetica non compartimentale ha evidenziato un’emivita di eliminazione terminale di primo ordine dal plasma di 1,94, 3,72 e 5,25 ore per il THC e di 5,28, 6,39 e 9,36 ore per il CBD in seguito alla somministrazione rispettivamente di 2, 4 e 8 applicazioni spray.[27]
Farmacodinamica
modificaI dati di uno studio di induzione di CYP in vitro hanno indicato che le concentrazioni plasmatiche di THC e CBD derivanti da dosi cliniche di Sativex potrebbero essere sufficienti a causare induzione di CYP1A2, 2B6 e CYP3A4 a livello del mRNA.[27]
In uno studio in vitro è stato rilevato che Sativex inibisce gli enzimi UGT1A9 e UGT2B7 a concentrazioni ottenibili nel contesto clinico.[27]
I recettori dei cannabinoidi e i recettori CB1 e CB2 fanno parte del sistema endocannabinoide umano (ECS) e come tali si trovano principalmente nei terminali nervosi dove svolgono un ruolo nella regolazione retrograda della funzione sinaptica. Il THC agisce quale agonista parziale in entrambi i recettori CB1 e CB2 imitando gli effetti degli endocannabinoidi che possono eventualmente modulare gli effetti dei neurotrasmettitori (ad es. ridurre gli effetti di neurotrasmettitori eccitatori quale il glutammato).[27]
Effetti del composto e usi clinici
modificaCommercializzato con il marchio Sativex, si tratta di uno spray orale indicato come trattamento per alleviare i sintomi in pazienti adulti affetti da spasticità da moderata a grave dovuta alla sclerosi multipla (SM) che non hanno manifestato una risposta adeguata ad altri medicinali antispastici e che hanno mostrato un miglioramento clinicamente significativo dei sintomi associati alla spasticità nel corso di un periodo di prova iniziale della terapia. L’uso di Sativex non è raccomandato nei bambini o adolescenti al di sotto di 18 anni di età per l’assenza di dati sulla sicurezza e l’efficacia.[27]
Studi rilevanti sull'uso nell'artrite reumatoide
modificaStudi nei topi avevano dimostrato che sia THC che CBD hanno effetti anti-infiammatori e che CBD blocca la progressione dell'artrite reumatoide con miglioramento dei sintomi[28].
Esiste un'evidenza aneddotica che la Cannabis possa risultare utile nel trattamento del dolore associato all'artrite reumatoide. In un'inchiesta, il 16% (155/947) delle persone che ha acquistato Cannabis al mercato nero ha dichiarato di aver ottenuto sollievo dai sintomi dell'artrite reumatoide[29].
Il primo studio che ha utilizzato un farmaco derivato dalla Cannabis nel trattamento dell'artrite reumatoide ha trovato che Sativex esercita un apprezzabile effetto sulla riduzione del dolore e una significativa influenza sulla soppressione della malattia[30]. Sebbene le differenze siano piccole e variabili nel gruppo di 56 pazienti studiati, i risultati sono statisticamente significativi.
Lo studio coordinato da David Blake del Royal National Hospital for Rheumatic Diseases (RNHRD) è il primo studio randomizzato, controllato con placebo, ad aver valutato un farmaco derivato dalla Cannabis nell'artrite reumatoide. Un totale di 58 pazienti sono stati assegnati in modo casuale a ricevere Sativex (n = 31) oppure placebo (n = 27), il trattamento è durato 3 settimane. È stato osservato che i pazienti trattati con Sativex hanno presentato, rispetto ai pazienti del gruppo placebo, significativi miglioramenti nel dolore in movimento e a riposo, nella qualità del sonno, nell'infiammazione (misurata mediante DAS28) e nell'intensità del dolore (misurata mediante SF-MPQ).[30]
Alla scala DAS28 (Disease Activity Score) con punteggio compreso tra 0 e 10, i pazienti che hanno assunto Sativex sono passati in media da 5.9 a 5 (placebo: da 6 a 5.9). Alla scala SF-MPQ con punteggio compreso tra 0 a 100, i pazienti del gruppo Sativex hanno ridotto il punteggio medio da 48 a 33, mentre i pazienti del gruppo placebo non hanno presentato variazioni; il punteggio è rimasto a 50. Gli effetti indesiderati sono risultati generalmente lieve-moderati. Tra gli 8 pazienti che hanno manifestato capogiri di lieve intensità, in 4 le reazioni avverse si sono presentate nelle prime 2 settimane quando era in corso l'aumento graduale del dosaggio, mentre in 2 pazienti i capogiri si sono presentati 2 giorni dopo l'assunzione del farmaco.[30]
Nessun paziente che ha assunto Sativex ha dovuto interrompere lo studio clinico per la comparsa di effetti indesiderati, contro i 3 del braccio placebo. I risultati del primo studio controllato che ha valutato Sativex nell'artrite reumatoide sono incoraggianti. La componente THC che è ritenuta responsabile dell'azione stupefacente della Cannabis ha un'attività farmacologica e non può essere rimossa dal farmaco.
Tuttavia, il metodo di somministrazione mediante spray orale ed il principio di auto-somministrazione, dove ciascun paziente determina in modo graduale la propria dose ottimale fino ad un massimo di 12 dosi giornaliere, rendono minimo il rischio di intossicazione.[30]
Controindicazioni ed effetti collaterali
modificaL’uso di Sativex è controindicato in pazienti:[27]
- con ipersensibilità ai cannabinoidi o a uno qualsiasi degli eccipienti,
- con storia o storia familiare nota o sospetta di schizofrenia o di altre malattie psicotiche, storia di gravi disturbi della personalità o altri significativi disturbi psichiatrici, esclusa la depressione associata alla malattia concomitante;
- che allattano, a causa degli elevati livelli di cannabinoidi eventualmente presenti nel latte materno e dei potenziali effetti avversi sullo sviluppo del bambino
L’uso del medicinale non è raccomandato in pazienti in gravi condizioni cardiovascolari. Alterazioni della frequenza cardiaca e della pressione sanguigna sono state osservate dopo la prima somministrazione per cui è essenziale usare cautela dopo la dose iniziale del periodo di titolazione. Si consiglia di prestare attenzione quando si trattano pazienti con storia di epilessia o crisi epilettiche.[27]
Le reazioni avverse includono:[27]
- molto comuni: capogiri, affaticamento
- comuni: anoressia, appetenza, depressione, disorientamento, dissociazione, euforia, amnesia, disturbi dell’equilibrio, disturbi dell’attenzione, disartria, disgeusia, letargia, compromissione della memoria, sonnolenza, visione annebbiata, vertigini, costipazione, diarrea, secchezza delle fauci, glossodinia, ulcere della bocca, nausea, fastidio orale, dolore orale, vomito, dolore nel sito di applicazione, astenia, senso di anormalità, senso di ubriachezza, malessere, cadute
- rare: faringite, allucinazioni, illusioni, paranoia, idee suicide, percezione delirante, sincope, palpitazioni, tachicardia, ipertensione, irritazione alla gola, dolori addominali (superiori), discolorazione della mucosa orale, disturbi della mucosa orale, esfoliazione della mucosa orale, stomatite, discolorazione dentale, irritazione del sito di applicazione
Interazioni
modificaPuò ridurre l’efficacia dei contraccettivi orali. La somministrazione concomitante di Sativex con altri substrati di CYP3A4 può causare un aumento della concentrazione plasmatica del farmaco concomitante.[27]
La somministrazione concomitante di Sativex con altri farmaci metabolizzati da enzimi del citocromo P-450 può accelerare il metabolismo e ridurre l’attività di questi altri farmaci, come cumarinici, statine, beta bloccanti e corticosteroidi.[27]
I pazienti con disordini genetici della glucuronidazione (ad es. morbo di Gilbert) possono mostrare concentrazioni di bilirubina elevate e devono essere trattati con cautela in caso di somministrazione concomitante di Sativex.[27]
Il trattamento concomitante con il ketoconazolo ha comportato un aumento dei valori di Cmax e AUC del THC (pari rispettivamente a 1,2 e 1,8 volte), del suo metabolita primario (pari rispettivamente a 3 e 3,6 volte) e del CBD (pari rispettivamente a 2 e 2 volte). Di conseguenza, se durante il trattamento con Sativex si inizia o si interrompe il trattamento con inibitori del CYP3A4 (es. itraconazolo, ritonavir, claritromicina), è necessaria una nuova titolazione.[27]
Il trattamento concomitante di Sativex (4 applicazioni spray) con fluconazolo (capsula da 200 mg) ha causato un aumento della Cmax media del THC del 22% e dell’AUC media del 32%. Anche l’esposizione al metabolita 11-OH-THC ha innalzato di circa 2,1 volte e 2,5 volte Cmax e AUC, rispettivamente, a indicare che il fluconazolo può inibirne il metabolismo successivo. Anche la Cmax del CBD è aumentata del 40% circa, mentre non ci sono state variazioni significative dell’AUC. Non c’è stata una variazione significativa dell’esposizione a 7-OH-CBD, sebbene sia stato notato un aumento del metabolita circolante minore del CBD, 6-OH CBD (fino a 2,2 volte in base a Cmax e AUC). La rilevanza clinica di questa interazione farmacologica non è del tutto compresa, ma si raccomanda cautela nella somministrazione concomitante di Sativex con inibitori potenti di CYP2C9, poiché potrebbe causare un aumento dell’esposizione a THC, CBD e rispettivi metaboliti.[27]
In seguito al trattamento con la rifampicina si è osservata una riduzione dei valori di Cmax e AUC del THC (40% e 20% rispettivamente), del suo metabolita primario (85% e 87% rispettivamente) e del CBD (50% e 60% rispettivamente). Di conseguenza, il trattamento concomitante con forti induttori degli enzimi (es. rifampicina, carbamazepina, fenitoina, fenobarbitale, Erba di San Giovanni) deve essere evitato ogni qualvolta possibile. Se ritenuto necessario, si raccomanda un’accurata titolazione entro due settimane successive l’interruzione dell’induttore.[27]
Si consiglia cautela nell’utilizzo di ipnotici, sedativi e di farmaci con potenziali effetti sedanti in quanto si potrebbe avere un effetto additivo della sedazione ed effetti sul rilassamento dei muscoli. Nonostante non sia stato osservato un aumento di eventi avversi in seguito all’uso di Sativex in pazienti che già assumevano antispastici, si consiglia di fare attenzione quando Sativex viene somministrato in concomitanza con tali medicinali in quanto potrebbe verificarsi una riduzione del tono e della potenza muscolare con conseguente maggior rischio di caduta.[27]
Sativex potrebbe interagire con l’alcol, con un effetto sul coordinamento, la concentrazione e sui riflessi. In genere le bevande alcoliche devono essere evitate durante l’uso di Sativex specialmente all’inizio del trattamento o quando si cambia la dose. I pazienti devono essere informati che se bevono alcolici mentre assumono Sativex, gli effetti additivi sul sistema nervoso centrale possono alterare la loro capacità di guidare o di usare macchinari e aumentare il rischio di cadute.[27]
Note
modifica- ^ a b c d Novartis Pharmaceuticals Australia Pty Limited, SATIVEX® (nabiximols) - Product information (PDF), 27 September 2013.
- ^ a b (EN) PubChem, Nabiximols, su pubchem.ncbi.nlm.nih.gov. URL consultato il 16 febbraio 2025.
- ^ Sativex Oromucosal Spray - Summary of Product Characteristics (SmPC) - (emc), su www.medicines.org.uk. URL consultato il 16 febbraio 2025.
- ^ Cannabis-based Sativex approved for NHS use in Scotland, in Pharmaceutical Journal, 2022, DOI:10.1211/pj.2022.1.157154. URL consultato il 16 febbraio 2025.
- ^ (EN) Nabiximols for multiple sclerosis, in Australian Prescriber, vol. 41, n. 6, 3 dicembre 2018, DOI:10.18773/austprescr.2018.066. URL consultato il 16 febbraio 2025.
- ^ Almirall, SATIVEX® OBTIENE LA RECOMENDACIÓN PARA APROBACIÓN EN SEIS PAÍSES EUROPEOS, 22 marzo 2011.
- ^ (CS) SÚKL - Přehled léčiv, su SÚKL - Přehled léčiv. URL consultato il 16 febbraio 2025.
- ^ (EN) Peter Flachenecker, A new multiple sclerosis spasticity treatment option: effect in everyday clinical practice and cost–effectiveness in Germany, in Expert Review of Neurotherapeutics, vol. 13, sup1, 2013-02, pp. 15-19, DOI:10.1586/ern.13.1. URL consultato il 16 febbraio 2025.
- ^ (DA) Sativex, komb. - information til sundhedsfaglige - Medicin.dk, su pro.medicin.dk. URL consultato il 16 febbraio 2025.
- ^ Sativex (Munhålespray ) • Bipacksedel | FASS Patient, su www.fass.se. URL consultato il 16 febbraio 2025.
- ^ GW Pharma Ltd., PRODUCT MONOGRAPH - SATIVEX (PDF).
- ^ GW receives Qualifying Notice for approval in Canada for Sativex (Press Release), su gwpharm.com, 22 ottobre 2007 (archiviato dall'url originale il 6 gennaio 2011).
- ^ Repubblica e Cantone Ticino, Dipartimento della sanità e della socialità, Divisione della salute pubblica, Ufficio del medico cantonale 6501 Bellinzona, Prescrizione di Sativex® (PDF).
- ^ Sativex, spray voor oromucosaal gebruik, su geneesmiddeleninformatiebank.nl. URL consultato il 16 febbraio 2025.
- ^ Questions et réponses au sujet des médicaments et autres produits à base de cannabis ou cannabidiol | AFMPS, su www.afmps.be. URL consultato il 16 febbraio 2025.
- ^ (DE) AGES Hanf-Informationen, su AGES. URL consultato il 16 febbraio 2025.
- ^ (FI) Fimea, [blob:https://fimea.fi/4629d690-8905-4a8c-9ae5-4aabbf66f084 Pakkausseloste: Tietoa potilaalle - Sativex sumute suuonteloon].
- ^ (NO) Cannabinol - Sativex, su NEL - Norsk Elektronisk Legehåndbok, 22 febbraio 2021. URL consultato il 16 febbraio 2025.
- ^ (FR) SATIVEX (cannabis (feuille et fleur de) riche en tétrahydrocannabinol) - Traitement des symptômes liés à une spasticité modérée à sévère due à une sclérose en plaques, su Haute Autorité de Santé. URL consultato il 16 febbraio 2025.
- ^ (PT) Observatório Português de Canábis Medicinal - OPCM, RESUMO DAS CARACTERÍSTICAS DO MEDICAMENTO - Sativex solução para pulverização bucal. (PDF).
- ^ Ανάρτηση Πράξεων στο Διαδίκτυο | Πρόγραμμα Δι@ύγεια -, su diavgeia.gov.gr. URL consultato il 16 febbraio 2025.
- ^ (HU) Hogyan igényelhetek kannabisz és kannabinoid-tartalmú készítményeket?, su tasz. URL consultato il 16 febbraio 2025.
- ^ (EN) Martyna Joanna Hordowicz, Jerzy Jarosz e Anna Klimkiewicz, To Treat or Not to Treat? Polish Physicians’ Opinions about the Clinical Aspects of Cannabinoids—An Online Survey, in Journal of Clinical Medicine, vol. 11, n. 1, 1º gennaio 2022, p. 236, DOI:10.3390/jcm11010236. URL consultato il 16 febbraio 2025.
- ^ Sativex® receives regulatory approval in Israel | Neopharm Group, su neopharmgroup.com. URL consultato il 16 febbraio 2025.
- ^ (SL) Dostop do zdravil s kanabinoidi v Republiki Sloveniji – JAZMP, su jazmp.si. URL consultato il 16 febbraio 2025.
- ^ antidroga.interno.gov.it, http://web.archive.org/web/20220217190153/https://antidroga.interno.gov.it/wp-content/uploads/2019/04/D.M.-11-febbraio-1997.pdf. URL consultato il 16 febbraio 2025 (archiviato dall'url originale il 17 febbraio 2022).
- ^ a b c d e f g h i j k l m n o p q r s t Jazz Pharmaceuticals Ireland Ltd e AIFA, RIASSUNTO DELLE CARATTERISTICHE DEL PRODOTTO - Sativex Spray per mucosa orale.
- ^ (EN) Malfait AM, Gallily R, Sumariwalla PF et al., The non-psychoactive cannabis-constituent cannabidiol is an oral anti-arthritic therapeutic in murine collagen-induced arthritis, in Proc Natl Acad Sci USA, vol. 97, 2000, pp. 9561-6.
- ^ (EN) Ware MA, Adams H, Guy GW, The medicinal use of cannabis in the UK: results of a nationwide survey, in Int J Clin Pract, vol. 3, 2005, pp. 291-5.
- ^ a b c d D. R. Blake, P. Robson, M. Ho, R. W. Jubb and C. S. McCabe, Preliminary assessment of the efficacy, tolerability and safety of a cannabis-based medicine (Sativex) in the treatment of pain caused by rheumatoid arthritis, in Rheumatology 2006, vol. 45, n. 1, 2006, pp. 50-52.
Voci correlate
modificaCollegamenti esterni
modifica- (EN) Sativex, su gwpharm.com.
- Istruzioni per l'importazione dall'estero, su medicalcannabis.it. URL consultato il 24 ottobre 2005 (archiviato dall'url originale il 27 ottobre 2005).
- (EN) Monografia Sativex [1]