Permanganato
Il permanganato (nome sistematico: tetraossomanganato(VII))[1] è un ossoanione del manganese eptavalente avente formula molecolare MnO4− e derivante formalmente dall'acido permanganico HMnO4 (instabile) per deprotonazione.[2] Le sue soluzioni acquose sono intensamente colorate in violetto.[3]

Lo ione permanganato è un ossidante forte specialmente in ambiente acido dove si riduce a Mn++ [E°(MnVII/MnII) = 1,51 V a pH 0][4] ed inoltre è cineticamente rapido, per cui le sue soluzioni acquose trovano utile impiego in chimica analitica qualitativa[5] e quantitativa.[6]
Il manganese, oltre al permanganato MnO4−, forma altri due anioni tetraossomanganato, con i quali non va confuso: il manganato MnO42− (MnVI) e l'ipomanganato MnO43− (MnV), che inoltre sono anioni paramagnetici.[7]
Struttura elettronica e molecolare
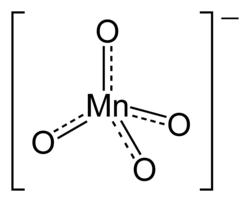
modificaL'anione MnO4− è isoelettronico con il cromato (CrO42−) e l'ortovanadato (VO43−), ed è isoelettronico di valenza con l'anione perclorato (ClO4−); tutte queste specie hanno struttura tetraedrica.[8]
Nel permanganato il manganese è e allo stato di ossidazione +7 (MnVII), il massimo per Mn, dato che in questo ione impegna tutti i suoi elettroni esterni 4s e 3d (specie d0).[9] Anche per questo, il suo potere ossidante si estende ai suoi sali, ma anche ad altre specie derivate di MnVII, ad esempio l'anidride permanganica Mn2O7 e agli ossoalogenuri corrispondenti (alogenuri di permanganile, −MnO3), quali MnO3F e MnO3Cl.[2][10]
La struttura geometrica dello ione, quale si può desumere da cristallografie ai raggi X dei permanganati alcalini, in particolare da quella di KMnO4, consiste di un atomo Mn al centro di un tetraedro regolare ai cui vertici giacciono quatto atomi di ossigeno; la distanza media Mn−O risulta pari a 162,9 pm.[11] Questa è leggermente più corta della distanza media Mn−O (165,9 pm) nel manganato di potassio K2MnO4, con MnVI invece che MnVII e che però è strutturalmente analogo.[12]
Sintesi
modificaI permanganati possono essere prodotti per ossidazione dei composti del manganese con forti agenti ossidanti, come ipoclorito, biossido di piombo, bismutati alcalini:
oppure, meno efficientemente, per dismutazione dei manganati:[13]
Produzione industriale
modificaViene prodotto a partire da minerali contenenti il biossido MnO2.
Per arrostimento vengono fatte le prime due ossidazioni: a Mn(V) e Mn(VI). Nel primo stadio si utilizza un impasto di minerale e potassa caustica, a temperature comprese tra 390 °C e 420 °C:
Poi a temperature comprese tra 180 e 330 °C e più lentamente:
L'ultima ossidazione a permanganato avviene per via elettrochimica.
Reattività
modificaÈ un forte ossidante, molto più potente del perclorato. Può distruggere completamente i composti organici.
In soluzione acida, il permanganato si riduce a ione Mn++, pressoché incolore, stato di ossidazione +2; il potenziale standard di riduzione è pari a E0 = 1,51 V:
In soluzione fortemente basica, il permanganato si riduce allo stato di ossidazione +6 dello ione manganato (MnO2−4), di colore verde intenso.
In ambiente debolmente basico o neutro si riduce a biossido di manganese (MnO2) con potenziale standard di riduzione E0 = 1,23 V:[13]
In ambiente di acido fosforico si forma Mn(III).
I permanganati non sono termicamente stabili. Per esempio, il permanganato di potassio si decompone a 230 °C:
Per riduzione con solfito dà ipomanganato (MnO3−4), di colore azzurro brillante.[13]
Preparazione delle soluzioni
modificaIl permanganato reagisce con molte impurezze che possono essere presenti nell'acqua usata per la preparazione della soluzione, in particolare sostanze organiche. Si decompone anche in presenza di biossido solido.
Pertanto le soluzioni preparate di fresco devono essere bollite per un'ora e filtrate su lana di vetro o setto poroso.
Composti
modificaFra i composti più utilizzati:
- Permanganato di potassio (KMnO4)
- Permanganato di sodio (NaMnO4)
Note
modifica- ^ (EN) Permanganate ion, su www.chemspider.com. URL consultato il 4 agosto 2025.
- ^ a b (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the Elements[collegamento interrotto], 2ª ed., Butterworth - Heinemann, 1997, pp. 1044-1047, ISBN 0-7506-3365-4.
- ^ (EN) Therald Moeller, John C. Bailar e Jakob Kleinberg, Chemistry with inorganic qualitative analysis, Academic Press, 1980, p. 892, ISBN 978-0-12-503350-3.
- ^ Egon Wiberg, Nils Wiberg e A. F. Holleman, Anorganische Chemie, 103. Auflage, De Gruyter, 2017, p. 1902, ISBN 978-3-11-026932-1.
- ^ G. Gioia Lobbia e G. Novara, ANALISI QUALITATIVA E COMPLEMENTI DI CHIMICA, Bulgarini, 1988, pp. 268-269.
- ^ (EN) 9.4: Redox Titrations, su Chemistry LibreTexts, 15 luglio 2019. URL consultato il 6 agosto 2025.
- ^ Egon Wiberg, Nils Wiberg e A. F. Holleman, Anorganische Chemie, 103. Auflage, De Gruyter, 2017, p. 1911, ISBN 978-3-11-026932-1.
- ^ (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the Elements[collegamento interrotto], 2ª ed., Butterworth - Heinemann, 1997, p. 1050, ISBN 0-7506-3365-4.
- ^ Nils Wiberg, Egon Wiberg e Arnold Frederik Holleman, Anorganische Chemie, 103. Auflage, De Gruyter, 2017, p. 1616, ISBN 978-3-11-026932-1.
- ^ (EN) Catherine E. Housecroft e Alan G. Sharpe, Inorganic chemistry, 3. ed, Pearson Prentice Hall, 2008, pp. 708-709, ISBN 978-0-13-175553-6.
- ^ Gus J. Palenik, Crystal structure of potassium permanganate, in Inorganic Chemistry, vol. 6, n. 3, 1º marzo 1967, pp. 503–507, DOI:10.1021/ic50049a015. URL consultato il 6 agosto 2025.
- ^ Gus J. Palenik, Crystal structure of potassium manganate, in Inorganic Chemistry, vol. 6, n. 3, 1º marzo 1967, pp. 507–511, DOI:10.1021/ic50049a016. URL consultato il 6 agosto 2025.
- ^ a b c N. N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Butterworth-Heinemann, 1997, pp. 1049-1050, ISBN 0-7506-3365-4.
Bibliografia
modifica- N. N. Greenwood e A. Earnshaw, Chimica degli elementi, II, Piccin, ISBN 88-299-1121-6.
- W. Büchner, R. Schliebs, G. Winter e K.H. Büchel, Chimica inorganica industriale, Piccin, ISBN 88-299-1348-0.
Voci correlate
modificaAltri progetti
modifica- Wikimedia Commons contiene immagini o altri file su permanganato
Collegamenti esterni
modifica- permanganato, su sapere.it, De Agostini.
- (EN) National Pollutant Inventory – Manganese and compounds Fact Sheet, su npi.gov.au. URL consultato il 26 giugno 2007 (archiviato dall'url originale il 1º marzo 2006).